锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。 (1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
C(s)+ —O2(g)=CO(g); △H = —110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = —460 kJ•mol-1
(4)煅烧还原的热化学方程式为: 。
(1)美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,已知正极反应式为O2+2H2O+4e-=4OH-,则负极反应式为:;
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,写出正极电极反应式:;工作一段时间,锌片的质量减少了3.25克,铜表面导线中通过 ____ mol电子。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪试些剂的洗气瓶( )
| A.澄清石灰水,浓H2SO4 | B.溴水,浓H2SO4 |
| C.酸性高锰酸钾溶液,浓H2SO4 | D.浓H2SO4,酸性高锰酸钾溶液 |
(3)写出乙烯与溴水的反应_____________________,反应类型为_________反应。
元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
| 元素 |
Al |
B |
Be |
C |
Cl |
X |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
3.0 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Y |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.8 |
(1)根据上表给出的数据,可知元素的电负性越大,____(填“金属性”或“非金属性”)越强。
(2)推测Y 为____(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程____________。
某氮肥厂氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:。
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如右:第一步反应是反应(选填“放热”或“吸热”),1molNH4+(aq)完全转化成NO3-(aq)共与环境交换了 __________kJ热量。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32g CH3OH转移6 mol电子,则生成的N2物质的量是。
下列物质中:
(1)互为同分异构体的有;(2)互为同素异形体的有;
(3)互为同位素的有;(4)互为同系物的有___________。(填序号)
①石墨②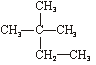 ③C60④CH4⑤
③C60④CH4⑤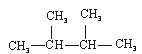 ⑥
⑥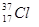 ⑦
⑦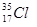 ⑧金刚石⑨C3H6⑩C4H10
⑧金刚石⑨C3H6⑩C4H10