从资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O = 7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.Cu2S既是氧化产物,又是还原产物 |
| B.产物中SO42-离子有一部分是氧化产物 |
| C.5 mol FeS2发生反应,有10 mol电子转移 |
| D.FeS2只作还原剂 |
可逆反应A(g)+3B(g)  2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是()
2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是()
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向正反应方向移动
D.乙中的热化学方程式为2C(g)  A(g)+3B(g);△H= +Q2kJ/mol
A(g)+3B(g);△H= +Q2kJ/mol
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2 2SO3,状态Ⅱ时达平衡,则O2的转化率为()
2SO3,状态Ⅱ时达平衡,则O2的转化率为()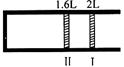
| A.40% | B.60% | C.80% | D.90% |
标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是()
A.1个A分子的质量是1个B分子的质量的 倍 倍 |
B.同温同体积的A与B的质量比为 |
C.同温同质量的A与B的分子数比为 |
D.同温同压下A与B的密度比为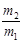 |
已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是()
| A.反应过程中的氧化产物均为SO3 |
| B.a点时剩余NaHSO3的物质的量为1.2 mol |
| C.b点时的还原产物可能是KI或NaI |
| D.当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1 mol |
下列离子方程式与所述事实相符且正确的是()
| A.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多: Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应: |
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2