下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。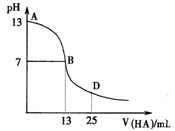
回答下列问题:
(1)上图能确定MOH为 (“强”或“弱”)碱,
理由是 。
(2)上图能确定HA为 (“强”或“弱”)酸,
理由是 。
(3)在D点时,溶液中c(A-)+c(HA) 2c(M+)。(填“>”、“<”或“=”)
(1)下列物质能导电的是 ,属于电解质的是 。
①NaOH固体 ②液态SO2 ③液态醋酸 ④液态金属钠
⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧融化的KNO3
(2)按要求写出下列方程式:
①钠与水反应的离子方程式:
②将NaHSO4溶液逐滴加入到Ba(OH)2溶液中,当Ba2+恰好沉淀完全时的离子方程式为:
(3)根据离子方程式,写出一个符合条件的化学方程式
CaO+2H+=Ca2++H2O
(4)今有K2SO4和Al2(SO4)3的混合溶液,其中K+物质的量浓度是0.2mol·L-1,SO42-物质的量浓度是0.7mol·L-1。则混合溶液中Al3+物质的量浓度应等于
下面有几种物质,请按要求回答问题。
①食盐与沙子
②从NaCl溶液中获得晶体
③水和汽油的混合物
④用CCl4提取碘水中的碘
(1)分离①、②的操作分别为___________、___________。
(2)③和④共同使用的仪器且在其他组分分离时无需使用,这种仪器是_______。
(3)上述需使用酒精灯的是________(填序号)。
(4)从碘的四氯化碳溶液中得到纯净的碘的方法是 。
已知反应:①SO3+H2O====H2SO4 ②Cl2+H2O====HCl+HClO
③2F2+2H2O====4HF+O2↑ ④2Na+2H2O====2NaOH+H2↑
⑤2Na2O2+2H2O====4NaOH+O2↑ ⑥SiO2+2NaOH====Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有__________(填序号,下同)。H2O被氧化的是___________,H2O被还原的是____________。属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的有_____________。
(2)写出方程式②的离子方程式_____________。
(3)用双线桥标出方程式④中电子转移的方向和数目_______________。
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+1/2O2(g)═CO(g) △H1=﹣110.35kJ·mol﹣1
2H2O(l)═2H2(g)+O2(g) △H2=+571.6kJ·mol﹣1
H2O(l)═H2O(g) △H3=+44.0kJ·mol﹣1
则C(s)+H2O(g)═CO(g)+H2(g) △H4= .
(2)燃料气(流速为1800mL·h﹣1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为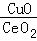 - HIO3,120℃时,反应1h后CO的体积为 mL.
- HIO3,120℃时,反应1h后CO的体积为 mL.
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为
(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
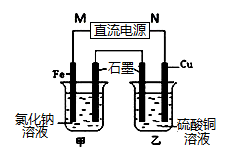
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。