化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,
其余为氧。A的相关反应如下图所示:
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。根据以上信息回答下列问题:
(1)A的分子式为 ;
(2)反应②的化学方程式是 :
(3)A的结构简式是 ;
(4)反应①的化学方程式是 。
(5)A有多种同分异构体,写出四个同时满足:
(i)能发生水解反应;
(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:
、 、
、 ;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为 。
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序。
(2)下列说法错误的是。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物(高或低),
原因是。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为(用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有。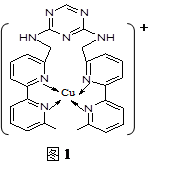
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示: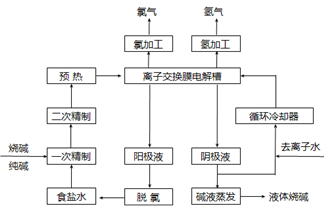
(1)该流程中可以循环的物质是。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是,E电极的名称是。电解总反应的离子方程式为。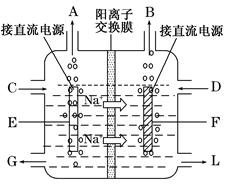
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为。
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g)△H1
2CO (g) +O2(g) =2CO2(g)△H2
2H2(g)+O2(g) =2H2O(g)△H3
则 CO(g) + 2H2(g)  CH3OH(g) 的△H=。
CH3OH(g) 的△H=。
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H0 (填>、<或=)。
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数(结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数(结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的 传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
①B极的电极反应式为。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀(填“能”或“否”)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下: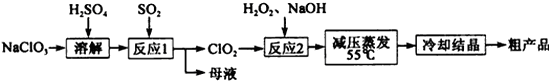
(1)提高“反应1”反应速率的措施有。(回答一点即可)
(2)“反应1” 的离子方程式是。
(3)“反应2”的氧化剂是,该反应的化学方程式为。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。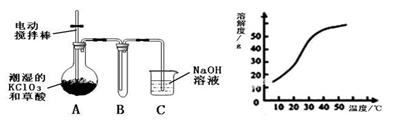
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;②;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。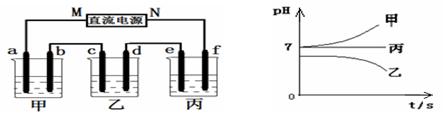
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式;
(2)电极f上发生的电极反应为;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是。