在Cu+2H2SO4(浓) CuSO4 +SO2↑+2H2O 反应中,
CuSO4 +SO2↑+2H2O 反应中,  是氧化剂, 还原剂是 , 元素被氧化, 是还原产物,电子转移的总数为 。
是氧化剂, 还原剂是 , 元素被氧化, 是还原产物,电子转移的总数为 。
在一定温度下,发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH_____0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为 。
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正 v逆(填“<”、“>”或“=”),平衡向 移动(填“正向”、“逆向”或“不移动”)。
合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
| A.ΔH>0,ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0,ΔS>0 | D.ΔH<0,ΔS<0 |
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s)ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+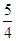 O2(g)===
O2(g)===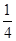 P4O10(s)ΔH 2=-738.5 kJ·mol-1
P4O10(s)ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
分一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)反应开始到平衡,用Z表示的反应速率为 mol·L-1·s-1,Y的转化率 。
(2)该反应的化学方程式为 。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是________________。
| A.t1时刻,增大了X的浓度 |
| B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 |
| D.t1时刻,使用了催化剂 |
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式__ ,该反应的△S____________0(填“>”或“<”或“=”),在_______________情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
| A.一定向正反应方向移动 |
| B.在平衡移动时正反应速率先增大后减小 |
| C.一定向逆反应方向移动 |
| D.在平衡移动时逆反应速率先减小后增大 |
(3)若反应的容器容积为2.0L,反应时间4.0 min,容器内氢气的质量减少了4.8g,在这段时间内CO2的平均反应速率为 。
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol |
0 |
1 |
2 |
3 |
4 |
| N2 |
2.0 |
1.83 |
1.7 |
1.6 |
1.6 |
| H2 |
6.0 |
5.49 |
5.1 |
4.8 |
4.8 |
| NH3 |
0 |
0.34 |
0.6 |
0.8 |
0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为_________________
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2