25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
| D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
常温下,如图是用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L HA溶液所得到的滴定曲线。下列相关的说法错误的是(忽略滴定前后体积变化)( )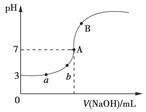
A.由图可知HA是一种弱酸,且Ka=1.0×10-5
B.水电离出的氢离子浓度:a<b
C.当NaOH溶液的体积为10.00 mL时,有:c(A-)+c(OH-)=c(H+)+c(HA)
D.B点溶液中的离子浓度关系可能为:c(Na+)>c(A-)>c(OH-)>c(H+)
某烃的相对分子质量小于70,1 mol该烃最多可与2 mol H2发生加成反应,加成产物最多能与10 mol Cl2发生取代反应,则该烃的分子式为
| A.C3H6 | B.C3H4 | C.C4H6 | D.C5 H8 |
以下实验能获得成功的是
| A.等量的CH4和Cl2在光照下反应生成纯净的CH3Cl |
| B.将铁屑、溴水、苯混合制溴苯 |
| C.在苯中滴入浓硝酸制硝基苯 |
| D.将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
| A.甲苯与硝酸发生取代反应生成三硝基甲苯 |
| B.甲苯能使热的KMnO4酸性溶液褪色 |
| C.甲苯燃烧时产生带浓烈黑烟的火焰 |
| D.1 mol甲苯最多能与3 mol氢气发生加成反应 |