下列叙述正确的是
| A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
B.有机物 的消去产物有两种 的消去产物有两种 |
| C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3 |
| D.可用溴水鉴别苯、四氯化碳和乙酸 |
实验表明:将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是()
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色外环呈红色或浅红色 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |
将3.20g Cu和10.0mol/L的硝酸30.0mL充分反应,还原产物中有NO和NO2。若反应后溶液中有amol  ,则此时溶液中
,则此时溶液中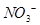 的物质的量为()
的物质的量为()
| A.a/2mol | B.2amol | C.0.100amol | D. |
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是()
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
已知下列反应①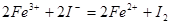 ;②
;②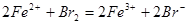 ;
;
③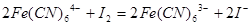 试判断下列物质的氧化性强弱顺序正确的是()
试判断下列物质的氧化性强弱顺序正确的是()
A.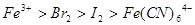 |
B.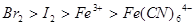 |
C.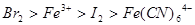 |
D.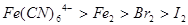 |
下列离子方程式表达不正确的是()
A.小苏打溶液跟烧碱溶液反应: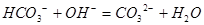 |
B.氢氧化钡溶液跟硫酸反应: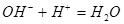 |
C.三氯化铁溶液跟过量氨水反应: |
D.氢氧化铝与氢氧化钠溶液反应: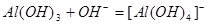 |