化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:(14分)
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水溶解、搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是___________________ ________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是___________________________ ____。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C 中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。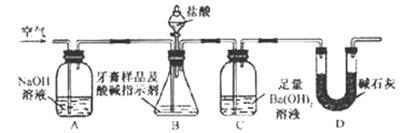
依据实验过程回答下列问题:
( 3)、检查B装置的气密性操作是
3)、检查B装置的气密性操作是
(4)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有的作用是:____________________________ _____。
(5)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为________ _。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________  _____。
_____。
以炼铅厂铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)为原料生产氯化锌的工艺流程如下:
(1)“酸浸”时一般控制温度为30 ℃,温度不宜过高的原因是。
(2)“氧化”时需控制溶液的pH为5。写出KMnO4氧化Fe2+为Fe3+的离子方程式。实际生产中高锰酸钾用量远多于理论用量的原因是。
(3)物质A的化学式是。
(4)写出流程中省略的操作步骤:,若操作不当则会产生杂质Zn(OH)Cl,欲降低产品中该杂质的含量,可以采取的方法是。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 |
SnS沉淀完全 |
FeS开始沉淀 |
FeS沉淀完全 |
|
| pH值 |
3.9 |
1.6 |
3.0 |
5.5 |
(1)操作II中,先通入硫化氢至饱和,目的是;后加入硫酸酸化至pH=2的作用是。
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②。
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知酸性KMnO4被FeSO4还原时生成Mn2+。写出该测定过程的离子反应方程式:;
②滴定时盛放KMnO4溶液的仪器为(填仪器名称)。
③判断此滴定实验达到终点的方法是。
④若实验操作无失误,测得上述样品中FeSO4·7H2O的含量仍偏低,则可能的原因是:。
氢氧化镁广泛用作阻燃剂和填充剂。以白云石(化学式:MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
(1)根据流程图,白云石“轻烧”分解的化学反应式是。
(2)“研磨”的目的是。
(3)加入氨水时反应的化学方程式为;
检验Mg(OH)2沉淀是否洗涤干净的方法是。
(4)本流程中可以循环利用的物质是。
(5)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是。
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式。
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠 (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl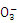 +6H+
+6H+ 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①;
②;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
2KClO3+H2C2O4+2H2SO4 2KHSO4+2ClO2+2CO2+2H2O。
2KHSO4+2ClO2+2CO2+2H2O。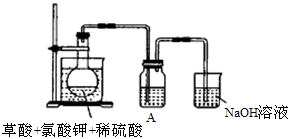
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是_______________________。
②装置A用于溶解产生的二氧化氯气体,其中最好盛放_______(填字母)。
a.20mL 60℃的温水b.100mL冰水
c.100mL饱和食盐水d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为______________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(Cl )。饮用水中ClO2、Cl
)。饮用水中ClO2、Cl 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
步骤1中若要量取20.00mL水样,则应选用的仪器是____________________________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为: 2ClO2+2KI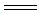 2KClO2+I2,2 Na2S2O3+I2
2KClO2+I2,2 Na2S2O3+I2 Na2S4O6+ 2NaI,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
Na2S4O6+ 2NaI,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
③步骤5的目的是用I-将溶液中的Cl 还原为Cl-以测定其含量,该反应的离子方程式为___________。
还原为Cl-以测定其含量,该反应的离子方程式为___________。