某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应。已知:溴苯的熔点为‒30.8℃,沸点156℃。
(1)三颈烧瓶中发生的有机反应化学方程式 ;
(2)仪器A的名称 ;本实验使用仪器A的原因 。而在实验室实际实验时并没有使用A的原因是 。
(3)锥形瓶中小试管内CCl4作用 ;如不加该部分装置将导致什么结果 。
(4)分液漏斗内的NaOH溶液作用: 。
孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下: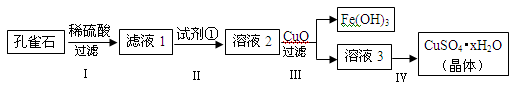
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)步骤Ⅱ中试剂①是__________(填代号)。
a.KMnO4b.H2O2c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是___________________________。
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(6)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.4g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______(计算结果精确到0.1)。
氧化亚铜是大型水面舰艇防护涂层的重要原料。某小组通过查阅资料,进行如下研究。
I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为。
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要。
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸。
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,用化学用语解释原因。
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是。
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜。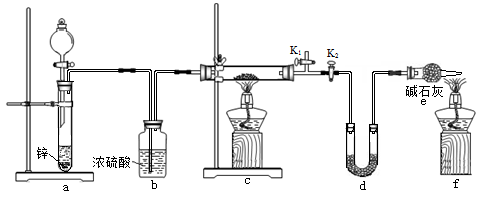
(5)装置a中所加的酸是(填化学式),装置e中碱石灰的作用是。
(6)点燃装置c中酒精灯之前需进行的操作是。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是。
铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g)  Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0
T1T2(填“>”、“<”或“=”),判断理由是
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
(1)溶解硼砂时需要的玻璃仪器有:烧杯和___________。
(2)用pH试纸测定溶液pH的操作方法为__________________________________。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为_________________________。
(4)实验流程中缺少的步骤a、步骤b操作分别为_________、_________。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
滴定步骤为:
①滴定到终点时溶液颜色变化是______________________________________。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为__________________(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____。(选填:“偏大”、“偏小”或“不变”)。
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
| 名称 |
相对分子质量 |
颜色,状态 |
沸点(℃) |
密度(g·cm-3) |
| 苯甲酸* |
122 |
无色片状晶体 |
249 |
1.2659 |
| 苯甲酸乙酯 |
150 |
无色澄清液体 |
212.6 |
1.05 |
| 乙醇 |
46 |
无色澄清液体 |
78.3 |
0.7893 |
| 环己烷 |
84 |
无色澄清液体 |
80.8 |
0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是(填入正确选项前的字母)。
A.25 mLB.50 mLC.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是。
(3)步骤②中应控制馏分的温度在。
A.65~70℃B.78~80℃ C.85~90℃D.215~220℃
(4)步骤③加入Na2CO3的作用是;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是。
(5)关于步骤③中的萃取分液操作叙述正确的是。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为。