(16分) Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-;
(2)酸性条件下S2O32-迅速分解为S和SO2
Ⅰ.市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
|
Ⅱ.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2=S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2)完成并配平步骤②中的离子反应: Cr2O72-+ ( )+ I- ="=" I2 + Cr3++ H2O
(3)步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 (Na2S2O3的摩尔质量为158g·mol-1)。
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
| 甲醇 |
64. 7 |
 |
0. 7915 |
易溶于水 |
| 乙醚 |
34. 5 |
 |
0. 7138 |
微溶于水 |
| 3,5-二甲氧基苯酚 |
 |
33 ~36 |
 |
易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
(2014届湖南省十三校高三第二次联考理综化学试卷)
三苯甲醇(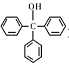 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。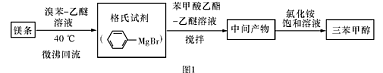
已知:(I)格氏试剂容易水解: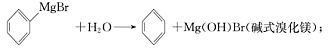
(Ⅱ)相关物质的物理性质如下: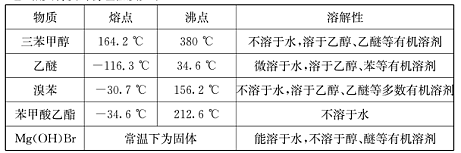
(Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。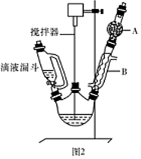
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 。
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:
其中,①操作为: ;洗涤液最好选用 (从以下选项中选择);
| A.水 | B.乙醚 | C.乙醇 | D.苯 |
检验产品已经洗涤干净的操作为: 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL。则产品中三苯甲醇的质量分数为 。
(2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
阿司匹林(乙酰水杨酸,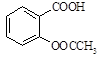 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: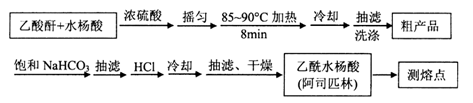
主要试剂和产品的物理常数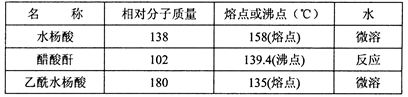
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是 。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
另一种改进的提纯方法,称为重结晶提纯法。方法如下: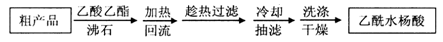
(3)改进的提纯方法中加热回流的装置如图所示,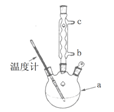
①使用温度计的目的是 。冷凝水的流进方向是 。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因 。
(4)检验产品中是否含有水杨酸的化学方法是 。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为 。
(2014届江西省南昌市高三3月第一次模拟考试理综化学试卷)
无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下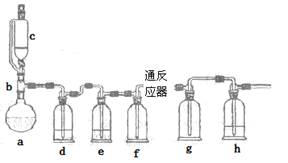
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、 、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| 观察到的部分现象 |
|
| 第一次实验 |
反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 |
反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 |
反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
(2014届江苏省高三百校联合调研测试(一)化学试卷)
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
| 物质 |
水 |
乙醇 |
乳酸 |
苯 |
乳酸乙酯 |
| 沸点/℃ |
100 |
78.4 |
122 |
80.10 |
154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下: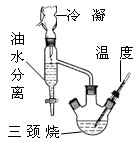
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石……;装上油水分离器和冷凝管,缓慢加热回流至反应完全。
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏。
(1)第一步操作中,还缺少的试剂是 ;加入苯的目的是 ;实验过程中,酯化反应进行完全的标志是 。
(2)第二步中证明“水洗”已经完成的实验方案是 。
(3)第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用 法。
(4)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有 个峰。