在原子结构的探索过程中,很多科学家作出了相应的贡献,我国古代的 认为物质是无限可分的,近代原子学说是由 提出的, 发现了铀的放射性,卢瑟福通过 实验,提出了原子结构的行星模型。
纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=_____mol/L;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=______mol/L;在该温度时,往水中滴入NaOH溶液,溶液中的C(OH-)=5.0×10-2 mol/L,则溶液的PH值为。 (已知lg5=0.7,lg3=0.477)
(8分)右图中电极a、b为Fe物件和Ag片,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答:
(1)直流电源中,M为_________________极。
(2)欲在Fe物件上镀上一薄层Ag,
①Fe物件应为_________极,(填a或b)
②Fe物件增重_________g。
(3)X溶液为____________,其浓度____________,(填“增大”“减小”或“不变”)
(4)若NaOH溶液的质量分数由5.00%变为5.02%,列式计算原NaOH溶液的质量。
450K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
△H=-96.56kJ/mol,△S=-190 J•mol-1•K-1。
甲容器在反应过程中保持压强不变,乙容器保
持体积不变,丙容器维持绝热,三容器各自建
立化学平衡。
(1)平衡常数:K (甲)K (乙)_K(丙) (填“>”、“<”或“=”)。
(2)达到平衡时SO2的转化率:α(甲) _α(乙) _ α(丙)(填“>”、“<”或“=”)。
(3)达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体, 甲容器的化学平衡________移动,乙容器的化学平衡_________移动。(填“正向”、“逆向” 或“不”)
(4)通过计算确定5000C时正反应 ____(填“能” 或“不能”)自发进行。
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。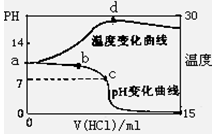
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点: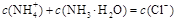
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
| 离子浓度的关系 |
溶质 |
溶液的pH |
物料守恒关系 |
|
| ① |
C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
pH>7 |
/ |
|
| ② |
NH4Cl |
/ |
||
| ③ |
C(Cl-)>C(H+)>C(NH4+)>C(OH-) |
pH<7 |
/ |
在一密闭体系中发生下列反应:N2(g)+3H2(g) 2NH3(g);△H<0 。
2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为______ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________。
(3)右图是某一时间段速率-时间曲线图。
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.