在2L密闭容器内,800℃时反应:2NO(g)+O2(g)≒2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知:K(300℃)>K(350℃),该反应是_ 。
(2)如图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。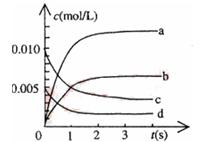
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变[
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目
(2)2.8gCO的物质的量为mol,含有个原子,完全与氧化铜反应时失去电子mol。
)下面是用98%的浓H2SO4(ρ="1.84" g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为。
(2)所需浓H2SO4的体积为。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的里,并不断搅拌。
(4)冷却后,将上述溶液转移到中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度处,改用加水,使溶液的凹液面正好跟刻度相平,摇匀。
)写出下列反应的离子方程式:
(1)氢氧化钠与硫酸反应;
(2)实验室制取CO2气体;
(3)少量CO2气体通入澄清石灰水;
(4)硫酸铜溶液与氢氧化钠反应。
某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验,加入试剂(或溶液),反应的离子方程式为;
(2)然后检验,加入试剂(或溶液),反应的离子方程式为;
(3)最后检验,加入试剂(或溶液),反应的离子方程式为。
下图是依各个原子的性质和原子序数(1~20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、最高正价、原子半径相对大小、得电子相对能力。图2中原子序数8、9和图3中原子序数2、10、18在纵轴上没有对应的数值。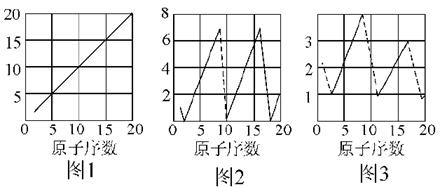
(1)图1~图3的纵轴分别代表__________、__________、__________;
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,③(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;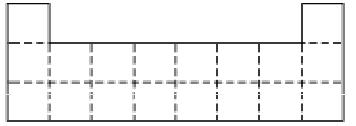
②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程_______________;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:
X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为__________________________。