常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上 述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所
示的装置: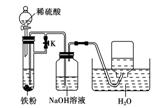
请简述实验操作及原理:
实验室用下图装置制取少量溴苯,试填写下列空白。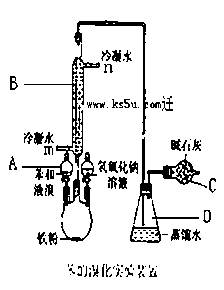
(1).写出仪器A的名称;B的名称;
(2).请你写出实验室制取溴苯的化学方程式 ___ ;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完毕后向烧瓶A中滴加NaOH 溶液的作用是
(5).冷凝水的进水口是(填m或n),,图中干燥管C的作用是
下图所示是进行木炭与浓硝酸反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染,现象明显的特点。具支试管A中所盛固体下层是无水CaCl2(作载体不参加反应),上层是红热的木炭。实验时慢慢将浓硝酸滴到木炭上,反应即开始进行
且能长时间剧烈反应。请回答下列问题:
|
|
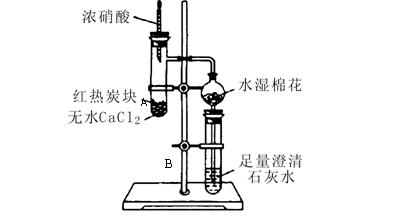
 ;澄清石灰水中发生的主要反应的离子方程式为: 。
;澄清石灰水中发生的主要反应的离子方程式为: 。
 几滴浓硝酸使
几滴浓硝酸使 木炭反应完全,最简单的办法是 。
木炭反应完全,最简单的办法是 。
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: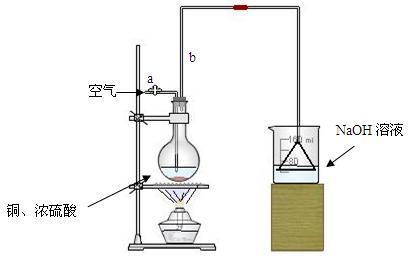
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行操作。
⑵烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行、、后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
某教师在课堂上用如图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质 。请回答下列问题:
。请回答下列问题: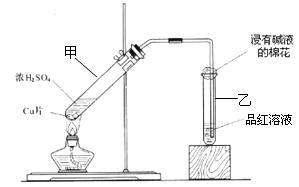
(1)试管乙中发生的现象是
该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/ L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB54 61 61 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装时期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方 程式是。
程式是。
② 某学生设计回收四氯化碳的操作步骤为:
某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取Wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是mg/kg。(以含w的代数式表示)