⑴浓度均为0.1mol/L的8种溶液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈 性,原 因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH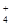 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO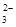 、AlO 、AlO |
为探究其成分,进行了以下探究实验。
⑴探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。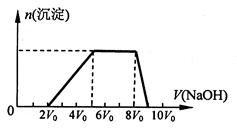
①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
含有的阳离子其对应物质的量浓度之比为__________________________________,
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
⑵探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
11.2 L |
22.4 L |
28.0 L |
| n (Cl-) |
2.5 mol |
3.5 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.5mol |
2.0 mol |
| n (I-) |
x mol |
0 |
0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 __________________________________________ ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
迷迭香酸(F)的结构简式为: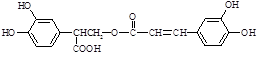 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A、E等为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A、E等为原料合成F的路线如下: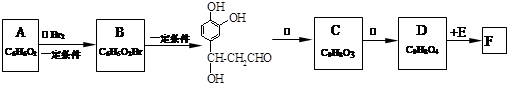
根据题意回答下列问题:
⑴写出结构简式:B____________________;C_____________________。
⑵写出反应类型:反应①________;反应②_____________。
⑶反应③所需的无机试剂:_____________________________。
⑷1 mol F分别与足量的溴水和NaOH溶液反应,最多可消耗Br2_____mol,NaOH____mol。
⑸D在一定条件下发生加聚反应的化学方程式是______________________________ 。
⑹与E互为同分异构体,且同时满足下列条件的有机物有_____________种。
①苯环上有四个取代基,且苯环上的一氯取代物只有一种。
②1 mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1 mol和4 mol。
资料1:精制碘盐的成分为NaCl和KIO3,其中碘的含量为20~40mg·kg-1。
资料2:日本地震导致福岛两座核电站反应堆发生故障,铯和碘的放射性同位素大量外泄。
资料3:专家认为,每天服用1片碘片(含碘量100mg)可有效减小人体甲状腺对放射性碘的吸收。
请认真阅读以上资料,并回答下列问题:
⑴铯在周期表中的位置是。
⑵下列物质中与KIO3含有化学键类型相同的是(填序号)。
①HIO3②碘酸钠③KOH④I2O5⑤NaCl
⑶向碘盐的溶液中加入白醋和KI,再滴入淀粉溶液,溶液呈蓝色,则发生反应的离子方程式为。
⑷若用精制碘盐来预防放射性碘对人体的伤害,是否可行?(填“行”、“不行”),原因是。
磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
⑴磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
⑵磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,
反应为:2Ca3(PO4)2+6SiO2= 6CaSiO3+P4O10 10C+P4O10= P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有。
⑶白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为。
今有十种物质:①铝线②石墨③CO2④BaSO4晶体⑤纯硫酸⑥金刚石⑦石灰水⑧乙醇⑨熔化的KNO3⑩液态HCl(填序号)
(1)其中,能导电的有,
(2)属于电解质的有,(3)属于非金属单质的有。