Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应: N2(g)+3H2(g)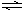 2NH3(g); △H<0
2NH3(g); △H<0
(1)工业生产中,该反应通常在高压下进行反应,做出此选择的理由是:
① ;
② 。
(2)开始时放入1mol N2和3mol H2,到达平衡后,生成amol NH3,若开始时放入χmol N2、3mol H2和y mol NH3,到达平衡后,NH3的物质的量为 3amol,则x= mol,y= mol。
Ⅱ、若该容器恒压、绝热(与外界不发生热交换),在一个与(2)反应前起始条件完全相同的容器中发生上述反应
(3)若开始时放入1mol N2和3mol H2,到达平衡后,生成b mol NH3,将b与(2)小题中的a进行比较 (选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
Ⅲ、某研究性学习小组为探究利用电化学原理合成氨,设计如图所示的装置,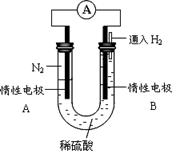
(4)电极B为 极
(5)电极A发生的电极反应式为
(6)该电池工作一段时间后,电解质溶液pH
(填增大、减小或不变)
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KC l为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
l为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: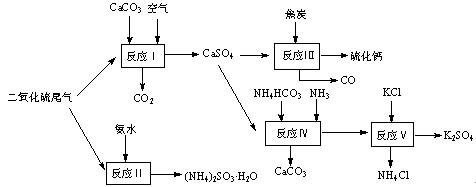
(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是。
(2)下列有关说法正确的是。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式。
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半 。回答下列问题:
。回答下列问题:
(1)写出B、E两元素形成化合物的电子式:,所含化学键类型;
(2)A、D、E、F的气态氢化物的稳定性顺序(用化学式表示)
(3)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
(4)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:
、
有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L。D的M层上有7个电子。
(1) A、B、C、D各是什么元素(写元素符号):
ABCD
(2)用电子式表示C与D形成化合物的过程:
。
(3)写出B、D的最高价氧化物的水化物反应的离子方程式:
。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5min Z的平均反应 速率为, X的转化率为;
速率为, X的转化率为;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为____________________。
(2)B中Sn极的电极反应式为____________________,
Sn极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是____ ____________________。
____________________。