(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是  。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1= 。若温度为400℃,平衡常数为K2,则K1 K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)="=" H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g) ;△H2=-283.0kJ/mol
CH4(g) +2 O2(g)="=" CO2(g) + 2H2O(l); △H3=-890.3kJ/mol
H2O(g) ="=" H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式 。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H= kJ/mol
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液;
②量取25.00 mL溶液,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)NaxFey(SO4)m(OH)n中x、y、m、n的代数关系式为 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: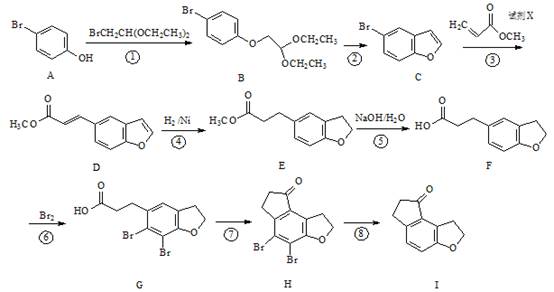
(1)反应④——⑧反应反应中,不属于取代反应的是 (填序号)。
(2)物质G中含氧官能团的名称为 、 。
(3)反应③中加入的试剂X的分子式为C4H6O2,X的结构简式为 。
(4)写出同时满足下列条件的物质I的一种同分异构体的结构简式 。
①能发生银镜反应;且水解产物之一能与FeCl3溶液发生显色反应。
②分子的核磁共振氢谱有5个峰,且分子中含有苯环。
(5)已知: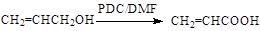
以 、
、 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下:
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示: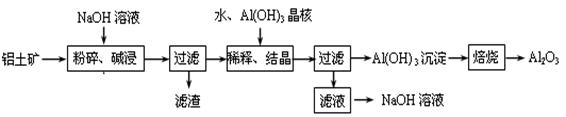
(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。碱浸时AlO(OH)与NaOH反应的化学方程式为 。滤渣的主要成分为 (填化学式)。
(2)上述“稀释、结晶”工艺后,溶液的pH将 (填“增大”、“减小”或“不变”)。
也可用通入足量的CO2气体的方法来代替,其原因是 (用离子方程式表示)。
(3)在空气中浓缩所得的NaOH溶液,得到的浓溶液中会混有杂质,该杂质可能为 。
铁及其合金在生活中用量极大,请回答下列问题:
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室用硫酸厂的烧渣(主要成份是Fe2O3及少量的FeS和SiO2制备绿矾。利用烧渣制备绿矾的流程如下:
(1)写出生成硫单质的化学方程式:
向溶液X加入足量铁屑所发生的离子方程式是:
(2)为了检验绿矾产品的FeSO4是否含有三价铁离子,所用的试剂是:
配制FeSO4溶液时,所用的蒸馏水需煮沸的原因是:
(3)溶液Y经操作①②可得绿矾晶体,则操作I是 ,操作II是 ,过滤 。
(4)镀铜可以防止铁制品的腐蚀,电镀时镀层金属是: ,阴极的反应式是:
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出当有1molCO反应时,理论上CO(g)还原FeO(s)所吸收的能量是:
(2)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。2NO + 2CO⇋N2 + 2CO2 △H< 0
| 实验编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| Ⅲ |
350 |
1.20×10-3 |
5.80×10-3 |
124 |
①以上三组实验的实验目的是 。
②请在给出的坐标图中,画出上表中的第三个实验条件
下混合气体中NO浓度随时间变化的趋势曲线图。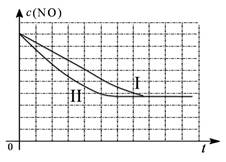
(3)汽车内燃机工作时引起反应:N2(g)+O2(g)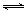 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。