今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中的HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计) ( )
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲=乙 | D.乙>丙>甲 |
下列叙述不正确的是
| A.NH3易液化,液氨常用作制冷剂 |
| B.与铜反应时,浓硝酸被还原成NO2而稀HNO3被还原成NO,所以稀HNO3氧化性强于浓HNO3 |
| C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D.氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解 |
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是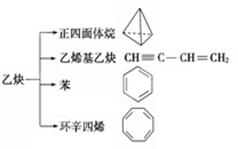
| A.正四面体烷的分子式为C4H4,其二氯代物有两种 |
| B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同 |
| C.苯为平面六边形结构,分子中存在C—C和C==C,能使酸性KMnO4溶液褪色 |
| D.环辛四烯跟苯的结构很像,不能使溴水褪色 |
下列反应的化学方程式或离子方程正确的是
A.CH3CH=CH2发生加聚反应: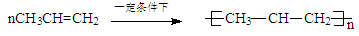 |
B.乙酸乙酯在酸性条件下水解: |
| C.SO2通入到BaCl2溶液中:SO2+ Ba2++H2O= BaSO3↓+2H+ |
| D.Fe(NO3)2溶液中滴加稀盐酸:3Fe2++4H++NO3- = 3Fe3++NO↑+2H2O |
下表为某有机物与各种试剂反应的现象,则这种有机物可能是
| 试剂 |
钠 |
溴水 |
NaHCO3 |
| 现象 |
放出气体 |
褪色 |
无气体放出 |
A.CH2=CH—COOH B.CH2=CH—CH3 C.CH3COOCH2CH3 D.CH2=CH—CH2—OH
下列说法不正确的是
| A.乙烯、苯、溴苯分子中的所有原子均共平面 |
| B.水加热至1000℃以上才分解是因为水分子间存在着氢键 |
| C.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸 |
| D.能发生银镜反应的有机物结构中一定含有-CHO |