某原电池总反应离子方程式为:2Fe3+ +Fe == 3 Fe2+,能实现该反应的原电池是( )
A 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
C 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D 正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
在一定的条件下,将10molH2和1molN2充入一密闭容器中,在适当条件下使其发生反应:N2+3H2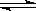 2NH3,达到平衡后。则H2的转化率可能是
2NH3,达到平衡后。则H2的转化率可能是
| A.35% | B.30% | C.25% | D.75% |
合成氨反应:N2(g)+3H2(g)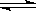 2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图: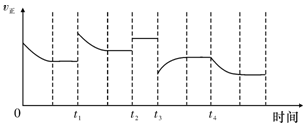
下列说法正确的是
| A.t1时升高了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
右图曲线a表示放热反应X(g) + Y(g) 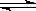 Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是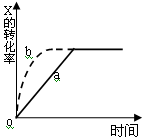
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
已知N2+3H2 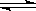 2NH3 △H<O ,反应速率为V1;2HI
2NH3 △H<O ,反应速率为V1;2HI 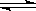 H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
| A.同时增大 | B.同时减小 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
在2A+B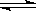 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A、υ(A)= 0.5 mol/(L·s) B、υ(D)= 1 mol/(L·s)
C、υ(C)= 0.8 mol/(L·s) D、υ(B)= 0.3 mol/(L·s)