、已知:2H2(g)+O2(g)=2 H2O(l) △H=" -571.6" kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH=" -241.8" kJ/mol
C3H4(g)+4O2(g) =3CO2(g) +2H2O(g) △H=" -2100.0" kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)的燃烧热为 ;
(2)1mol和2molC3H4组成的混合气体完全燃烧生成液态水时释放的热量为
;
(3)现有和C3H4的混合气体 共5mol,完全燃烧生成CO2和气态水时,则放出热量(
共5mol,完全燃烧生成CO2和气态水时,则放出热量( Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。
Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: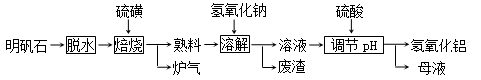
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为。
2Al 2O3+9SO2,其中氧化剂为。
(2)“溶解”时反应的离子方程式为。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是。
下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH2K2CO3+6H2O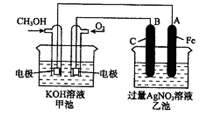
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:
氧化反应式;还原反应式。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为。
下图所示水槽中试管内有一枚铁钉,放置数天后观察: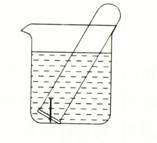
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀,正极反应式为。
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①~④均为化合反应。回答下列问题: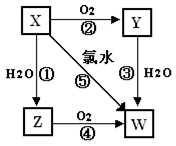
(1)Y的化学式为___________,Z的化学式为____________。X直接排入空气中易造成的环境问题是_______________________。
(2)反应①~⑤中属于可逆反应的是______________。
(3)反应⑤的化学方程式为:_______________________________________________。