一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:
氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为 。
有机物X(分子式为C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多。经测定该有机物具有下表中所列性质,请根据题目要求填空:
(1)
| X的性质 |
推测X中关于官能团的结论 |
| ①X与足量Na反应产生H2 |
|
| ②X与醇或羧酸在浓硫酸作用下并加热均生成有香味的产物 |
|
| ③在一定条件下X的分子内脱水产物(非环状化合物)可与溴水发生加成反应 |
含—OH |
| ④33.5 g X与100 mL 5 mol·L-1 NaOH溶液恰好中和 |
(2)写出X发生①反应的化学方程式(任写一个)。
(3)在一定条件下X可发生化学反应的类型有。(填序号)
a.水解反应
b.取代反应
c.加成反应
d.消去反应
e.加聚反应
(4)下列物质与X互为同系物的是_______。与X互为同分异构体的是_______(填序号)
A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得石蜡油的方法是_________,由石蜡油获得A是________变化。
(2)写出A→B的反应方程式:该反应的类型是____________________写出反应B+C→D的化学方程式:____________________________
该反应的类型是。
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是mol
(4)实验室制备D的实验装置图如图所示:收集产物的试管中盛放的液体为;该溶液的作用有:①除掉产物中的和杂质;②
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:
①________________________
②________________________
、(1)有机化合物的结构简式可进一步简化,如: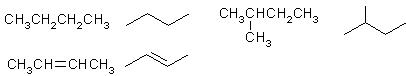
写出下列物质的分子式:
①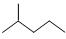 分子式用系统命名法对该有机物进行命名_______________
分子式用系统命名法对该有机物进行命名_______________
② 分子式
分子式
③ 分子式______________
分子式______________
(2)除去下列物质中的杂质(括号内为杂质),填入所用试剂和分离方法。
①乙烯(SO2),试剂,分离方法______________
②苯(溴),试剂,分离方法______________
下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为。
(3)C催化氧化生成D的化学方程式为。
(4)有机物B具有的性质是 (填序号)。
①无色无味的液体;
②有毒;
③不溶于水;
④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明)。
《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(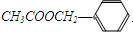 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: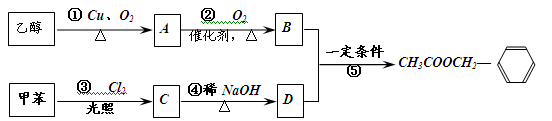
(1)在①②③④⑤五个反应中,属于取代反应的是:(填序号);
(2)B中的含氧官能团的名称是:。
(3)D的含苯环的同分异构体中,能使FeCl3溶液显紫色的有种;
(4)反应⑤ 中120克B与足量的D反应,若B的转化率为60%,则生成乙酸苯甲酯克。
(5)写出乙酸苯甲酯的符合条件的同分异构体的结构简式(写其中一种)。
①含苯环,能发生水解反应和银镜反应;
②苯环上有两种不同化学环境的氢原子