(共10分)完成下列填空:
A . 将下列化学方程式改写成离子方程式,离子方程式改写成化学方程式:
⑴ Na2CO3+2HCl="=" 2NaCl+CO2↑+H2O ______________________;
⑵ Fe+ Cu 2+="=" Fe2+ +Cu ____________________________。
B.写出下列反应的离子方程式
(1)实验室用锌与稀硫酸反应制氢气: ;
(2)盐酸溶液与氢氧化钠溶液: ;
(3)稀硫酸与氢氧化钡溶液: .
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为__________________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ =" _____" Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):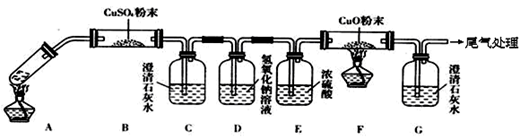
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。
乙二酸分解的化学方程式为_____________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是__________________。(用文字简单表述)
(5)以上溶液中各离子的浓度由大到小的顺序为:_____________________________;(用离子符号表示)
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为
红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题: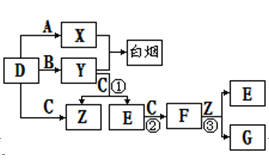
(1)D的化学式为;
(2)反应③的离子方程式为。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)原因是: __________________________________
(用离子方程式说明)
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是()
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
有机物A只含有C.H、O三种元素,常用作有机合成的中间体。16. 8g该有机物经燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1。
(1)A的分子式是____。A的结构简式是。
(2)下列物质中,一定条件能与A发生反应的是——。
A.H2 B.Na C.KMnO4 D.Br2
(3)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B中含氧官能团的名称是,B的结构简式是____。
(4)B可以通过下列变化得到四元环状化合物F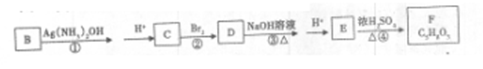
请写出反应③化学方程式;
上述转化关系中①、②、④的反应类型是:____,,。
已知A、B、c、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如右图。请回答:
(1)A与c形成的共价化合物的分子式是,杂化轨道是____,分子的立体结构是____。
(2)B与C比较,电负性较小的是(填元素符号);B与c形成的化合物晶体类型是。
(3)E属元素周期表中第周期,第族的元素,其元素名称是,
它的+2价离子的电子排布式为。
(4)从图中可以看出,D踉B形成的离子化合物的化学式为;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是(只要求列出算式)。
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)△H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2 |
60 |
43 |
28 |
15 |
| 3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率(填“增大”“减小”
“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。
a.该条件下此反应的化学平衡常数表达式为
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是(填“乙醇”或“氧气”),b处电极上发生的电极反应是:。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。