下列实验中,合理的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100mL 量筒量取5.20mL 盐酸
C .用托盘天平称取25.20g NaCl固体
.用托盘天平称取25.20g NaCl固体
D.用100mL 容量瓶配制125mL 0.1mol·L-1盐酸
以下是一些常用的危险品标志,装运浓硫酸的贮运罐应贴的图标是()
A B C D
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()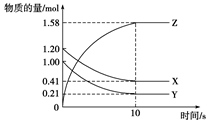
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压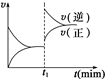
强,速率的变化都符合示意图的反应是()
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
|
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
|
C.H2(g)+I2(g) 2HI(g);ΔH>0 2HI(g);ΔH>0 |
D.2A(g)+B(g) 2C(g);ΔH>0 2C(g);ΔH>0 |
反应A2+B2 2AB在温度和压强改变条件下,产物AB的生成情况如图所示。a为500℃,b为
2AB在温度和压强改变条件下,产物AB的生成情况如图所示。a为500℃,b为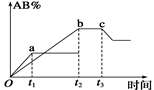
300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙
述正确的是()
| A.A2、B2、AB均为气体,正反应放热 |
| B.AB为气体,A2、B2中最少有一种为非气体,正反应放热 |
| C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热 |
| D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |
在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g) cC(g)+dD(g),达到
cC(g)+dD(g),达到
平衡时测得B气体的浓度为0.6 mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B
气体的浓度为0.4 mol/L,下列叙述中正确的是()
| A.a+b〈 c+d | B.平衡向右移动 |
| C.重新达平衡时,A气体转化率增大 | D.重新达平衡时,D的体积分数减小 |