A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;其氢化物的水溶液显 性。
(2)B元素的负二价离子和C元素的正二价离子的电子层结构都与氩相同,B的最高价氧化物的化学式为 ,C的元素 符号为 ;
符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备的工艺流程如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是,加入锡粉的作用是。
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
。
(3) 检验沉淀已经“洗涤”干净的操作是:。
(4)反应II硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH。(已知:Ksp[Sn(OH)2]=1.0×10-26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:。
重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
现有0.20 mol BaSO4,加入1.0L 2.0mol•L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。
在一定条件下,NO与NO2混合可生成N2O3,反应的化学方程式为:NO(g)+NO2(g) N2O3(g) ΔH<0
N2O3(g) ΔH<0
下图表示一定量的NO、NO2混合气体发生反应时,NO2浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向_______移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:___________________________________,该反应的氧化剂是______________。
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为。
(3)用化学平衡移动原理说明③中煮沸的作用是(用离子方程式结合文字说明),若调节pH过低产生的影响是。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式:。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: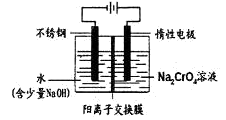
阴极发生的电极反应式为:。
阳极发生的电极反应式为:。
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):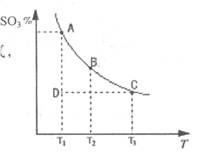
①2SO2(g)+O2(g) 2SO3(g)的△H0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将移动(填“向左”、“向右”或“不”);
2SO3(g)的△H0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正V逆(填“>”、“<”或“=”)。
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式。(△H用含Q1、Q2的代数式表示)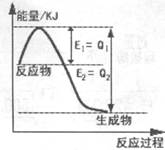
②25°C时,将a mol • L―1的氨水与b mol • L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+)c(Cl―),ab(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2•L―2、Ksp(AgI)=1.5×10―16mol2•L―2。
在 250C时,向 10mL0.002mol•L―1的 NaCl溶液中滴入 10mL0.002mol•L―1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴人0.1mol •L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是,该反应的离子方程式。