重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
现有0.20 mol BaSO4,加入1.0L 2.0mol•L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。
X、Y、Z为三种常见 的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
(1)当X、Y均为金属时,X的化学式为 ,Z为(填名称)。
(2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ____,
A的化学式为。
(3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式 为
为
。
(4)当X、Y均为非金属 固体时,X与A反应的化学方程式为
固体时,X与A反应的化学方程式为
。
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
最外层电子数是内层电子数的3倍 |
| C |
1molC单质能与 冷水反应,在标准状况下生成11.2LH2 冷水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2) D在周期表中的位置为 ________________;
(3)B和C简单离子的半径大小为________ __;(用离子符
__;(用离子符 号和“>”、“=”或“<”表示)
号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是___________( 写化学式,下同),既含离子键又含共价键的是______________。
写化学式,下同),既含离子键又含共价键的是______________。
材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
(1)①合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为(填元素符号)。
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果,其负极反应式为。 ③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
(2)聚苯乙烯是造成白色污染的物质之一,其结构简式为 ,则制取聚苯乙烯的单体是。
,则制取聚苯乙烯的单体是。
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
(1)①人类的生命活动需要糖类、、维生素、水、和无机盐(或矿物质)等六大素营养物质。
②阿司匹林具有作用。长期大量服用阿司匹林,其水解产物水杨酸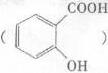 可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
(2)蛋白质在人体内水解的最终产物是氨基酸。请在下图虚 线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
线方框内写上适当的官能团符号,将氨基酸的通式补充完整: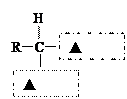
(3)淀粉水解的最终产物是若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入碱液调到碱性,再加入(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴溶液,应观察到出现蓝色。
(1)(3分)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是(填字母)。
a.CO2b.N2c.NO2
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内。
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是(填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(2)酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因。

(3)汽车尾气中一氧化氮与一氧化碳催化转化的 化学方程式为。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是,ClO2的作用是。
化学方程式为。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是,ClO2的作用是。