化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: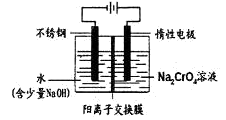
阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程: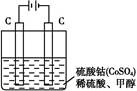
①写出阳极电极反应式:。
②写出除去甲醇的离子方程式:。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式:。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图: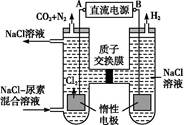
①电源的负极为(填“A”或“B”)。
②阳极室中发生的反应依次为。
③电解结束后,阴极室溶液的pH与电解前相比将;若两极共收集到气体13.44 L(标准状况),则除去的尿素为g (忽略气体的溶解)。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
S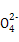 、OH- 、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题: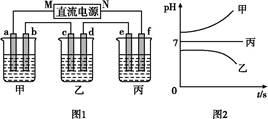
(1) M为直流电源的极,b电极上发生的电极反应为。
(2)计算e电极上生成的气体在标准状况下的体积为。
(3)写出乙烧杯中的总反应的离子方程式:。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: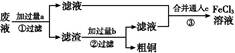
写出一个能证明还原性Fe比Cu强的离子方程式:。
该反应在上图步骤中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式。
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:常温下将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: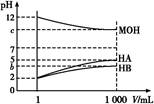
(1)HA为酸,HB为酸(填“强”或“弱”)。
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为(用酸、碱化学式表示)。
(3)若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为c(A-)(填“大于”、“小于”或“等于”)c(M+)。
(4)若b+c=14,则MOH为碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH7(填“大于”、“小于”或“等于”)。
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)ΔH>0
Ca2+(aq)+A2-(aq)ΔH>0
①温度升高时,Ksp(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:。