某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示的装置进行有关实验。请回答: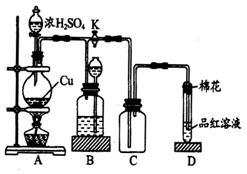
(1)装置A中发生的化学反应方程式为 。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。B中应放置的液体是 (填字母)。
a. 水 b. 酸性KMnO4溶液 c. 浓溴水 d. 饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直 到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是 。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是 (填字母)。
a. 铁粉 b. BaCl2溶液 c. 银粉 d. Na2CO3溶液
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4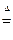 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。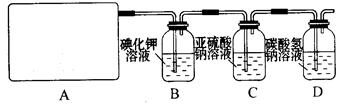
试回答:
(1)该实验中A部分的装置是(填写装置的序号)。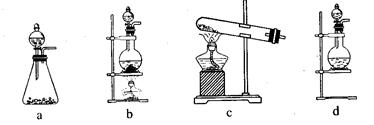
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式。
(4)该实验存在明显的缺陷,请你提出改进的方法。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒④1000 mL容量瓶⑤250 mL容量瓶 ⑥托盘天平(带砝码)⑦玻璃棒还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是、。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。
Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
| 实验步骤 |
预期现象和结论 |
(本题共12分)今有一无色透明溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Fe3+、Ba2+、SO42-、CO32-、NO3-,现取二份各100 mL溶液进行如下实验:
①第一份加足量NaHCO3溶液加热后,收集到气体0.04mol
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得沉淀4.66 g。
根据上述实验回答
⑴溶液中一定不存在的离子是;⑵溶液中可能存的离子是;
⑶写出①发生反应的离子方程式________________________________________________________;
⑷写出②发生反应的离子方程式________________________________________________________;
某研究性学习小组的同学利用下图来验证一定质量的铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数,已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。
(1)写出A中铜与硝酸反应的一个化学方程式;
(2)C装置的作用是;
(3)反应结束后,打开活塞K2,并通入O2,若 实验中有NO产生,则在D中可观察到的现象是;
实验中有NO产生,则在D中可观察到的现象是;
(4)反应前要先打开活塞K1持续通入一段时间的N2,其理由是;
(5)利用A装置中反应后的溶液还可确定铜的质量分数,方法是:取出A中反应后的溶液,先向其中加入足量的溶液,然后再进行,, ,。(填操作名称)
,。(填操作名称)