如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题: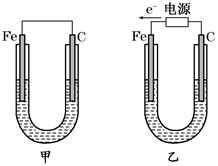
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。
阿司匹林(乙酰水杨酸,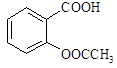 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸) 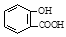 与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: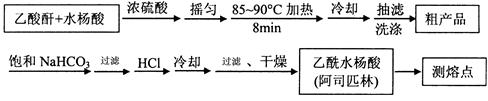
主要试剂和产品的物理常数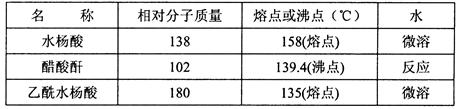
请根据以上信息回答下列问题:
(1)制备阿司匹林时,仪器应干燥,其原因是。
该加热过程中,温度计控制的温度
(2)写出制备阿司匹林的化学方程式。
(3) ① 合成阿斯匹林时,加饱和NaHCO3的作用是。
② 过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是。
(4)检验产品中是否含有水杨酸的试剂是。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.1 g,则所得乙酰水杨酸的产率为。
(Ⅰ)室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。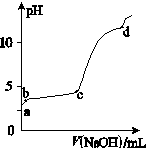
(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式:,
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
A.可在酸性氧化物中寻找B.可在碱性氧化物中寻找
C.可在ⅠA、ⅡA族元素形成的氧化物中寻找 D.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: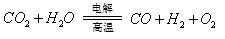 已知:
已知: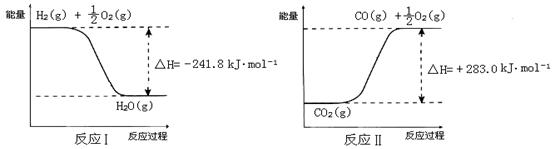
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是。
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3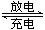 Na2S4+3NaBr闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr闭合开关K时,b极附近先变红色。则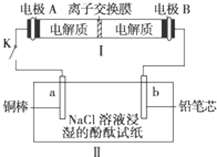
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为mL
③闭合K后,b电极附近的pH(填变大、变小或不变);
同时a电极反应式为
由X、Y两种元素组成的离子化合物A。在空气中充分灼烧得到含X元素的16g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得93.2g固体。
(1)写出A的电子式 。
(2)在此过程中,消耗5 mol/L的双氧水的体积至少为。
(3)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,则该反应的化学方程式。
(4)将化合物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是_______;