(本题10分)
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH浓硫酸170 ℃CH2===CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的 杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是________(填编号)。
| A.使溴水褪色的反应,未必是加成反应 |
| B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的气体,未必是乙烯 |
| D.使溴水褪色的气体,就是乙烯 |
(2)乙同学推测此乙烯中可能含有的一种杂质气体是____________,它与溴水发生反应的化学方程式是___________________,在验证过程中必须全部除去。
(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法?
(10分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发 生反应的离子方程式是 ;
生反应的离子方程式是 ;
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN ,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=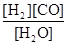 ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g) 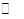 2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g) 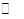 H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g) 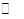 CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则 K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g) 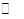 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )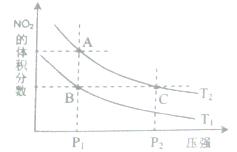
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中N02的含量最高的一段时间是。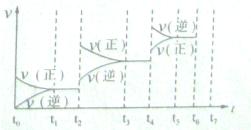
(10分)
1:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是。
Ⅱ:探究家庭制备次氯酸钠溶液的发生器如图,原理是用石墨做电极电解饱和食盐水。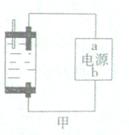
(1)若通电后,为使氯气被全部吸收,则电源的a极的名称是。
(2)电解饱和食盐水的离子方程式为,所得的次氯酸钠溶液中加入几滴石蕊试液,观察到的现象是,用离子方程式和简要文字说明理由。
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反 应,过滤结晶即可;
应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是__________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①试说明HnB的酸性强弱_______________________________________.
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)________________.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为
_______________________________________________________.
c(OH-)-c(HB)=________.
④当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为__________(保留整数值).
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=__________________________,该温度下XnYm的溶解度S=____________.