下表是元素周期表的一部分,针对所给的元素,完成下列各小题
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
C |
N |
O |
F |
Ne |
| 3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
| 4 |
K |
Ca |
|
|
|
|
Br |
|
(1)第三周期中原子半径最大、金属性最 强元素是 (填元素名称);
强元素是 (填元素名称);
(2)氖原子结构示意图为 ;(3)N与O中,原子半径较大的是 。
(4)形成化合物种类最多的元素是 ;它的最高价氧化物对应的水化物的化学式
(5)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(6)N元素形成的一种氢化物的化学式是 ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应化学方程式 。
分析下列有机物的结构简式,指出它们分别含有哪些官能团,写出这些官能团的结构简式及名称: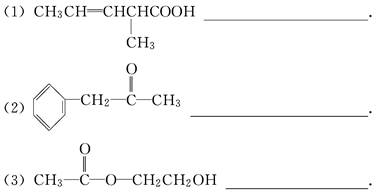
在下列化合物中:①CH3—CH3、②CH3CH===CH2、

属于环状化合物的是______,属于脂环化合物的是______,属于芳香化合物的是______,属于芳香烃的是________,属于脂肪烃的是________.
元素A、B是周期表中处在同一主族,相邻周期的两种元素,A的原子序数为m,A、B所在周期包含的元素种类分别为x、y。
(1)如果A和B同在ⅡA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________;
(2)如果A和B同在ⅥA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________。
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是、、、。(2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为______________________,写出有关离子方程式_________________________________;_________________________________。
下列分子结构:CO2、CH4、PCl5、Na2O2、MgF2,其中原子的最外层不能都满足8电子稳定结构的是;属于离子化合物,且离子个数之比是2:1或1:2的是。