(1)装盛碱液的试剂瓶不能用玻璃塞的原因用化学方程式解释, 化学方程式是: 。
化学方程式是: 。
(2)久置的浓硝酸变黄色,化学方程式: 。
在101 kPa时,1.00 g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8 kJ的热量,表示C6H6燃烧热的热化学方程式为:__________________________________.
从海水中提取金属镁的生产步骤有:①浓缩结晶,②加熟石灰,③加盐酸,④过滤,⑤熔融电解,正确的生产步骤是。(填序号)
“冶炼金属常用以下几种方法:
①热还原法②离子交换法③电渗析法④电解法⑤热分解法。
下列金属各采用哪种方法还原最佳(用序号填写下列空白)。
(1)Na、、Al等活泼或较活泼金属。(2)Hg、Ag等不活泼金属。
(3)Fe、Zn等金属______________________
下面列出了几组物质,请将物质的合适组号填写在空格上。
| A.金刚石与石墨; | B.淀粉和纤维素; | C.氕与氘 | D.甲烷与戊烷; |
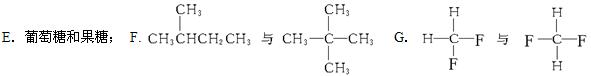
(1)同位素;(2)同素异形体;
(3)同系物;(4)同分异构体;
(5)同一物质。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题: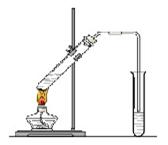
⑴写出制取乙酸乙酯的化学反应方程式:
。
⑵饱和碳酸钠溶液的主要作用是:。
。
⑶装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑷做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。