A、B、C、D均为有机化合物。请根据以下框图,回答问题:
(1)B不含有支链,则B的结构简式为 ,其中含有的官能团是 。
(2)C含有支链,在浓硫酸作用下加热反应只能生成一种烯烃D(不考虑立体异构),则D的结构简式为 ,其名称(系统命名)是 。
(3)C在催化剂Cu的作用下被氧气氧化为有机物E,E能发生银镜反应,则C的结构简式为 。
(4)写出反应①的化学方程式: ,其反应类型是 。
(5)物质B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式: 。
i)既能发生银镜反应,又能发生水解反应
ii)其核磁共振氢谱有三种类型氢原子的吸收峰
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
①水,调成泥浆②稀硫酸调pH为1~2③煮沸④过滤―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。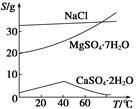
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的 时,b=,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=。
时,b=,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=。
(3)a的取值范围是。
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1=。
(2)若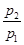 =0.64,则反应前混合气中丁烷的物质的量分数=。
=0.64,则反应前混合气中丁烷的物质的量分数=。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是L。
(1)下列说法不正确的是________(填字母序号)。
| A.60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于碱性氧化物 |
| B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 |
| C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 |
| D.液氨、液氯、液态氯化氢都是非电解质 |
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。
①1887年阿仑尼乌斯提出电离理论。
②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子的水溶液既可看作酸又可看作碱的是________(填字母序号)。
AH2O;BNH4+;COH-;DHCO3-;ECH3COO-;FCl-
③1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [OH]- → HOH
试指出下列两个反应中的酸或碱:
H3BO3+H2O=H++[B(OH)4]-
该反应中的碱是________(填“H3BO3”或“H2O”);
CuCl2+4NH3=[Cu(NH3)4]2++2Cl-
该反应中的酸是________(填“CuCl2”或“NH3”)。
根据物质的组成和性质将下列无机化合物进行了分类。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
氢化物 |
| 化学式 |
①H2SO4 ②______ |
③NaOH ④______ |
⑤Na2SO4 ⑥______ |
⑦SO2 ⑧Na2O |
⑨HCl ⑩_____ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为________________________________________________________________________。
(3)将⑦通入③的溶液中,反应的离子方程式为_______________________________________。
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水后也能电离出氯离子。检验溶液中氯离子的方法是_____________________________________________。