下列离子方程式书写正确的是
| A.石灰乳与Na2CO3溶液混合: Ca2++CO32-=CaCO3 |
| B.NH4HSO3溶液与足量的NaOH溶液混合加热: NH4++HSO3-+2OH-=NH3+SO32-+2H2O |
| C.酸性条件下KIO3溶液与KI溶液发生反应生成I2: IO3-+5I-+3H2O=3I2+6OH- |
| D.AgNO3溶液中加入过量的氨水: |
Ag++NH3·H2O=AgOH↓+NH4+
根据H+H H2同时放出436 kJ·mol-1的热量,可以说明( )
H2同时放出436 kJ·mol-1的热量,可以说明( )
| A.氢分子比氢原子稳定 |
| B.氢分子跟氢原子稳定性一样 |
| C.两个氢原子比一个氢分子能量高 |
| D.氢原子比氢分子稳定 |
下列说法正确的是( )
| A.若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B.H3O+离子的存在,说明共价键不应有饱和性 |
| C.所有共价键都有方向性 |
| D.两个原子之间形成共价键时,可形成多个σ键 |
1999年曾报道合成和分离了含高能量的正离子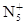 的化合物N5AsF6,下列叙述错误的是( )
的化合物N5AsF6,下列叙述错误的是( )
A.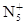 共有34个核外电子 共有34个核外电子 |
B.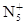 中氮原子以共用电子对结合 中氮原子以共用电子对结合 |
| C.化合物N5AsF6中As的化合价为+1 |
| D.化合物N5AsF6中F的化合价为-1 |
下列关于化学键的叙述正确的是( )
| A.离子化合物可含共价键 |
| B.共价化合物可含离子键 |
| C.离子化合物只含离子键 |
| D.共价化合物不含离子键 |
下列物质中全部含有极性键的是( )
| A.Br2、CO2、H2O、HBr |
| B.CO2、O2、H2S、HCl |
| C.Na2O2、S8、CO2、H2O |
| D.CO2、H2S、H2O、HI |