煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) 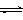 CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与__________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 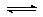 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为__________。
②该反应的逆反应为 __________(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)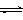 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。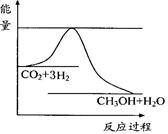
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(1)除去溴苯中的溴,应选用的试剂为________________,实验方法为__________,主要实验仪器为_____________________;
(2)溴乙烷和氢氧化钠溶液充分反应后,加入________________________,若现象为__________________________,则证明溴乙烷中含有溴元素;
(3)用乙炔制备聚氯乙烯塑料的化学反应方程式为________________________;
________________________________________。(其它无机物任选)
(10分)根据下列变化关系: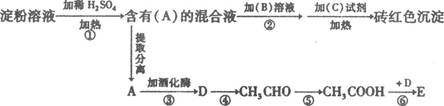
请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
(10分)下列所示的装置中A为Zn,B为Cu,C、D均为碳棒。
则(1)A发生了____反应(填氧化或还原).C为____极。
(2)D极周围溶液中的现象____________________________________
原因是__________________________________________
(3)当A电极上的金属质量减少1.3g,则C电极上产生气体在标准状况下的体积为_________________________L。
(6分)已知A、B、C、D四种短周期元素在元素周期表中的相对位置如下图所示,它们的原子序数之和为46。
请填空:
(1)C元素的元素符号为______________________________
D元素的原子结构示意图____________________________
(2)B元素氢化物的电子式____________________________________
(3)A元素可以形成多种同素异形体,其中硬度最大,不导电的是________________(填物质的名称),它属于_____________晶体;熔点高,可以导电的是_____________(填物质的名称)。
(8分) 在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答:
(1) (用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________