丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知: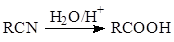

(1)A的结构简式为: ;
(2)反应④的类型为: 反应;
(3) D与足量乙醇反应生成E的化学方程式为: 。
(4) 与足量NaOH溶液反应的化学方程式为 。
与足量NaOH溶液反应的化学方程式为 。
(5)B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式: 、 。
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:



 (1)反应I前需在FeSO4溶液中加入(填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入(填字母),以除去溶液中的Fe3+。
| A.锌粉 | B.铁屑 | C.KI溶液 | D.H2 |
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是。 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是。 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为。
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为:
(1)氨催化氧化的化学方程式为: (2)原料气中空气必须过量,其主要原因是;
(2)原料气中空气必须过量,其主要原因是; (3)将铂铑合金做成薄丝网的主要原因是;
(3)将铂铑合金做成薄丝网的主要原因是; (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)。
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%O2 11% N2 82%);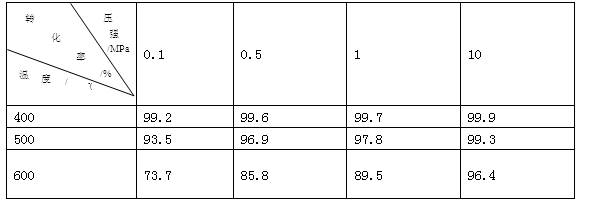
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论? ;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(3)选择适宜的催化剂,是否可以提高SO2的转化率?(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
28g KOH固体必须溶解在________g水中,才能使每200个水分子中有1个K+,所得溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为________。(保留到小数点后两位)
有一包白色粉末可能含有Na2SO4、Na2CO3、KCl、Ba(NO3)2、CuSO4中的一种或几种,按以下步骤进行实验:
(1)将固体粉末溶于水得无色溶液和白色沉淀;
(2)加入稀盐酸,沉淀部分溶解且有气泡产生。
(3)在(2)的滤液中加入硝酸酸化的硝酸银有白色沉淀。
根据以上实验所产生得现象,判断这种混合物里,一定含有,一定没有,可能有的物质是。
写出前两步所发生反应的离子方程式。