离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③化合物 ④盐
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。 (3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na2CO3 溶液,有白色沉淀生成,证明______存在,又排除________存在。
溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中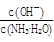 (增大、减小、不变)
(增大、减小、不变)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH7(填“>”“<”或“=”)。
(3)若向该氨水中加入氢氧化钠固体,则该电离平衡向方向移动(分子化、离子化),电离平衡常数。(增大、减小或不变)
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生反应。
(1)生成了molSO3,SO2的转化率为。
(2)平衡时容器内气体的总物质的量为mol。
(3)平衡时SO2的浓度是mol/L。
下列材料后回答问题
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+ Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂;
Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中具有性,人体缺少铁元素可能会患,
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐.离子方程式为 ___ __。
下列常用物质: A小苏打 B阿斯匹林 C葡萄糖 D苯甲酸钠 E柠檬黄 F维生素A(请用字母填充)具有解热镇痛疗效的是,可以直接进入人体补充能量的是 可以作为食品防腐剂的是,常用作食品着色剂的是 可用作治治疗胃酸过多的是,人体缺少会患夜盲症的是 。
材料是人类赖以生存的重要基础物质,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
(1)生活中的玻璃、陶瓷、水泥属于上述材料中的________________,其生产原料不需要使用石灰石的是_____________。塑料制品给人类生活带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害。请你提出一项防治“白色污染”的有效措施:
(2)我们常说的三大合成材料是指:塑料、合成纤维和
(3)金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的发生电化学腐蚀。