已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作 是 ,需用到的玻璃仪器除烧杯外有
是 ,需用到的玻璃仪器除烧杯外有  。
。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 
 。
。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 
。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。
完成下列反应的离子方程式
(1)Ba(OH)2溶液加入过量NaHCO3溶液_____。
(2)NaClO溶液中通入少量CO2_____。
(3)将Fe(NO3)3溶液与过量HI混合_____。
(4)向FeBr2中通入等量Cl2_____。
(1)若40g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca(NO3)2,则溶液中NO的物质的量浓度为 mol/L
(2)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为 mol/L
(3)NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物所含共用电子对数目为_____,所含碳氢键数目为_____。
(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有的原子的物质的量为________mol,所有的电子的物质的量为________mol。
(3)1.204×1023个NH4+的物质的量为________mol,质量为________g。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。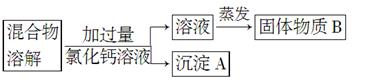
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是________________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为_____________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为________________