根据反应:①Zn+2HCl=ZnCl2+H2↑ ②MnO2+4HCl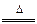 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
③2HCl+CuO=CuCl2+H2O,推知盐酸应当具有的性质有 。
某课外活动小组进行下列实验(如下图所示)。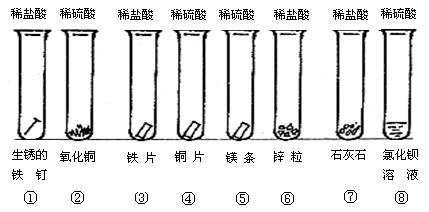
(1)某同学将这些实验分成三组,各组的试管编号是:第一组①②;第二组③④⑤⑥;第三组⑦⑧。
你认为如此分组的依据是:。
(2)写出试管②⑤⑧的实验现象及有关的离子方程式:
②;。
⑤;。
⑧;。
从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________还原性最强;Cu2+、Fe2+、Ag+中,_______________氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
写出下列电离方程式或反应的离子方程式
(1)硫酸铝电离的电离方程式 ________________:
(2)向澄清石灰水中加硝酸 ________________;
(3)用石灰石与盐酸反应制取二氧化碳 _________________;
(4)锌粉加入硫酸溶液中 _______________;
(5)向Na2CO3溶液中滴加几滴稀盐酸: _______________。
用18.4 mol·L-1的浓硫酸配制100mL1.0mol·L-1稀硫酸。
(1)需量取浓硫酸的体积为mL(保留一位小数)。
(2)若实验仪器有:
(A)100mL量筒 (B)托盘天平 (C)玻璃棒 (D)50mL容量瓶 (E)10mL量筒 (F)胶头滴管(G)50mL烧杯 (H)100mL容量瓶
实验时选用的仪器除C、F、G外还应选用(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
(A)定容时俯视刻度线观察液面;
(B)容量瓶使用时未干燥;
(C)定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶的使用中,下列操作不正确的是(填序号)
(A)使用容量瓶前检查它是否漏水
(B)容量瓶用蒸馏水洗净后,不用待配制的溶液洗涤
(C)将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
(D)将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
(E)定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm—3 |
溶解性 |
| A |
—11.5 |
198 |
1.11 |
A、B互溶, 且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:(填“过滤”、“蒸发”、“萃取”、“分液”、“蒸馏”等)