有五个系列同族元素的物质,101.3 kP时测定它们的沸点(℃)如下表所示:
| ① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
| ② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
| ③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
| ④ |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
| ⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中不正确的是( )
A.a、b、c的化学式分别为Ne、Br2、HF
B.系列②物质均有氧 化性;系列③物质对应水溶液除c外其它均是强酸
化性;系列③物质对应水溶液除c外其它均是强酸
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g)△H=-92.6 kJ·mol-1
2XY3(g)△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |
常温下,下列各组离子在指定溶液中可能大量共存的是:
| A.滴入甲基橙显红色的溶液中: Na+、NO3ˉ、 Fe2+、SO32ˉ |
| B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、 Clˉ |
C.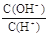 =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ |
| D.c ( Fe 3+ ) =" 0" .1 mol/L 的溶液中: K+、Clˉ 、SO42ˉ、 SCNˉ |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是:
A.2A(g) + B(g) 2C(g) ΔH>0 2C(g) ΔH>0 |
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
C.H2(g) + I2(g)  2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0 4NO(g) + 6H2O(g)ΔH<0 |
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
| A.2. 3×10-7mol·L-1 | B.4. 6×10-7mol·L-1 |
| C.9. 2×10-7mol·L-1 | D.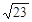 ×10-3mol·L-1 ×10-3mol·L-1 |