镁粉在焰火、闪光粉、鞭炮中是不可少的原料,工业上制造镁粉是将镁蒸气在某种气体中冷却。 现有下列气体:①空气②CO2③Ar④H2⑤N2,其中可作为冷却气体的是
现有下列气体:①空气②CO2③Ar④H2⑤N2,其中可作为冷却气体的是
| A.①和② | B.②和③ | C.③和④ | D.④和⑤ |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e—=Li2S+Fe。有关该电池的下列说法中,正确的是
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
C.负极的电极反应式为Al-3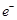 =Al3+ =Al3+ |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e—=2Li++FeS |
有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2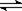 2SO3。
2SO3。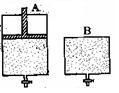
则下列描述正确的是
| A.达到平衡所需要的时间:A容器更短 |
| B.达到平衡时:B容器中SO3的转化率更大 |
| C.达到平衡时:A容器中SO2的物质的量更多 |
| D.达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变 |
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。当有1 mol H2O参与反应时,转移电子的物质的量为
| A.0.5 mol | B.1 mol | C.2 mol | D.4 mol |
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,关闭电源,向所得溶液中需加入0.2molCu(OH)2恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
下列化学反应的离子方程式正确的是
A.往明矾溶液中逐滴加入氢氧化钡溶液至SO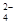 恰好完全沉淀Al3+ + 2 SO 恰好完全沉淀Al3+ + 2 SO +2 Ba2+ + 4 OH— =" 2" BaSO4 +2 Ba2+ + 4 OH— =" 2" BaSO4 + AlO2— + 2 H2O + AlO2— + 2 H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO +2HClO |
C.用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S |
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+ +NH4+ |