下列各溶液中,微粒的物质的量浓度关系正确的是
A.10 mL 0.5 mol·L-1CH3COONa溶液与6 mL 1 mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol·L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑次要:Cu2+ + CO32─= CuCO3↓
(2) CuSO4 +Na2S主要:Cu2+ + S2─ = CuS↓ 次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2< CuS < CuCO3 |
已知下列热化学方程式:
Zn(s)+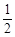 O2(g)=ZnO(s)△H =-351.1kJ·mol-1
O2(g)=ZnO(s)△H =-351.1kJ·mol-1
Hg(l)+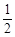 O2(g)=HgO(s)△H =-90.7 kJ·mol-1
O2(g)=HgO(s)△H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为
| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |
下列说法中正确的是
| A.凡是放热反应都是自发的,吸热反应都是非自发的 |
| B.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| C.熵增加且放热的反应一定是自发反应 |
| D.非自发反应在任何条件下都不能实现 |
在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g) N2O4(g) △H<0。把烧瓶
N2O4(g) △H<0。把烧瓶
置于100℃的水中,则下列几项性质中不会改变的是
①颜色②平均分子量③质量④压强⑤密度
| A.①和③ | B.②和④ | C.④和⑤ | D.③和⑤ |