实验室制取乙烯的装置如右图所示,请根据图 示回答下列问题:
示回答下列问题:
(1)在烧瓶中放入 酒精和浓硫酸(体积比约为
酒精和浓硫酸(体积比约为
1∶3)的混合液,为避免混合液暴沸,常放入少量 。加热混合液使液体温度迅速升到 时就有乙烯生成。
(2)实验室制乙烯的化学方程式是:
。在这个反应中,浓硫酸所起到的作用是 。
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(CH3COOH) 溶液,有关数据记录如下表:
| V/(NaOH)/mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
| 溶液pH |
2.87 |
4.74 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
12.50 |
①根据上表数据绘制0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(HAc)溶液的滴定曲线。
②根据你所绘制的曲线,确定pH的突变范围是________。
③下列指示剂中适合于本实验的是________。(填序号)
A.甲基橙 B.石蕊 C.酚酞
判断到达滴定终点的实验现象
(2)滴定过程中,眼睛应重点观察__。
如下图是常见仪器的部分结构。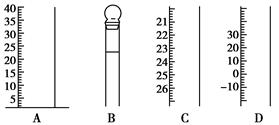
(1)写出仪器名称:A________,B________,C________,
(2)使用前需检查是否漏水的仪器有________。(填序号)
常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HCl物质的量浓度(mol·L-1) |
AOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.1 |
c |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH=5 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明AOH是强碱还是弱碱。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.1________(选填“是”或“否”)。
(3)丙组实验所得溶液中由水电离出的c(OH-)=________mol·L-1。
为了验证Cu和浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置: B中有无水硫酸铜、C中有品红溶液、D中有氢氧化钠溶液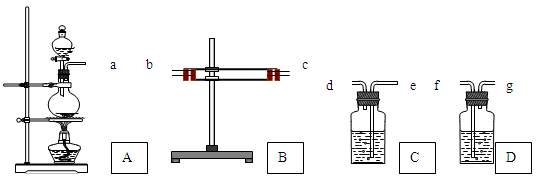
(1) 如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
a接,接,接;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?
B中,C中;
若将 B、C装置前后对调,对实验有何影响
。
(3) D中氢氧化钠溶液的作用是;
(4) 写出A中反应的化学方程式。
实验室利用图所示装置进行NaHCO3的受热分解实验。请回答: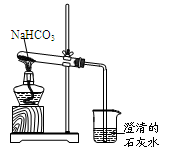
(1)加热一段时间后,烧杯中观察到的实验现象是。
(2)实验结束时的正确操作是(填序号),否则会引起。
①先将导管从液体中移出,再熄灭酒精灯
②先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是。