某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。

(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是。过一会儿,他又发现铜片表面有银白色固体附着,这说明。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
| 实验步骤 |
实验现象 |
实验结论 |
|
|
|
|
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:
以下是实验室常用部分仪器:
(1) 指出图中仪器的名称:④;
(2) 小李同学选择仪器制取并收集氧气,已知他使用了仪器①③⑤⑥,那么他还需要使用上图仪器中的(填序号);该发生装置检查气密性的方法是:把导管的一端浸在水里,用手紧贴试管外壁,若导管口有,则说明该装置不漏气。
(3)小张同学正在收集一瓶CO2, 不知是否收集满了,其验满方法是。
(4)某兴趣小组选用上述仪器,用锌粒和稀硫酸制氢气,锌粒反应完后,发现还有较多的灰黑色固体物质,从反应后的混合物中分离得到该灰黑色固体的操作方法是。
【提出问题】灰黑色固体物质的成分是什么呢?
【提出猜想】①可能含有单质碳;②可能含有单质铜;③可能还有其它物质
【设计实验】请设计实验用化学方法证明该灰黑色固体物质中是否含有单质碳和单质铜。完成下表(不一定要填满):
| 步骤 |
实 验 方 法 |
现 象 和 结 论 |
| 1 |
||
| 2 |
||
| 3 |
【反思讨论】上述各步反应完全后,兴趣小组的同学还收集到了少量剩余黑色固体物质,为了进一步探究剩余固体物质的成分,兴趣小组的同学讨论后,认为用初中化学知识无法解决,你对下一步的探究学习活动的合理建议是:首先。
Ag、Cu、Fe和Al是生产或生活中广泛使用的金属。
⑴四种金属中,不是银白色的是。
⑵铁制品容易锈蚀,铁生锈的条件是。生锈的废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为。
⑶根据下图所示回答:滤渣中一定有的金属是,滤渣与稀盐酸反应的化学方程式为;滤液中的溶质是。
在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应;
⑵一个有沉淀生成的反应。
【挖掘实质】
⑴图26-1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是(填离子符号)。
⑵图26-2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H+ + OH- = H2O
我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质。
【实践运用】
⑴通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中和(填离子符号,下同)也不能大量共存。
⑵利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液。经测定,该溶液显酸性。则在该溶液中一定含有的离子是。为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证。
| 溶液中可能含有的离子 |
设计实验验证(实验步骤、现象及对应的结论) |
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是。
实验室制取常见气体所需装置如下图所示。请回答以下问题: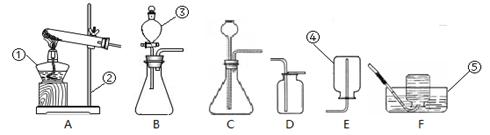
(1)写出图中带序号仪器的名称:
①_________; ②_________;③_________;④_________;⑤_________。
(2)选用发生装置_____(填标号,下同)可用来制取CO2,收集该气体可用装置
反应文字表达式或化学式表达式为____________,验满方法是
,选用该收集装置的理由是____________,获得该种气体的(2)选用发生装置_____(填标号,下同)可用来制取CO2,收集该气体可用装置
反应文字表达式或化学式表达式为____________,验满方法是
______________。
(3)实验室用加热高锰酸钾的方法制取氧气的反应文字表达式或化学式表达式为,应选用的发生装置是(填标号),用该装置制取氧气还应该在试管口________,目的是________________。
(4)小红用家里的粗铜丝和废塑料药瓶组装成一套装置(如右图所示)用于完成制取某些气体的实验,得到了老师的表扬。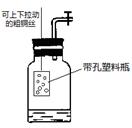
Ⅰ.利用该装置完成实验的优点是(填序号)。
①可控制反应的进程 ②能完全消除废液排放 ③产生的气体不含任何杂质
Ⅱ.该装置与上图装置_______(选填“B”或“C”)在制取气体时具有相类似的优点。
某实验小组利用图5所示仪器进行“配制质量分数一定的氯化钠溶液”的实验(提示:图7中凹液面与“80”上方两格处相切)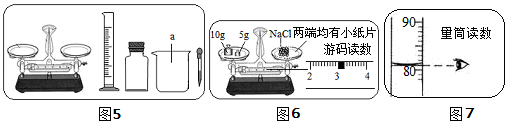
(1)图5中仪器a的名称是,按实验要求,图5中还缺少的玻璃仪器是(填名称),在实验中该仪器的作用是;
(2)完成此实验的正确的操作顺序是(填序号);①溶解,②装瓶贴标签,③称量,④计算
(3)马虎同学按图6的操作称取氯化钠,细心同学发现马虎的操作有错误。你认为马虎同学操作中的错误是,他称取的氯化钠实际质量为g;
(4)聪明同学量取蒸馏水的体积如图7所示,则该实验小组原计划配制的氯化钠溶液中溶质质量分数为(水的密度为1g/cm3),图6的错误操作使配得的溶质的质量分数(填“不变”、“偏大”或“偏小”)。