在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2), 当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成 氮气和液态水时,放出的热量是________kJ。
氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快 速产生大量气体外,还有一个很突出的优点是________________________。
速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1, N2H4(g)+O2(g)="=="  N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_______________________________________。
N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_______________________________________。
(5)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________________________
现在要分离下列物质,将分离方法的字母序号填在横线上。
| A.萃取 | B.加热分解 |
| C.结晶 | D.分液 |
E.蒸馏 F.过滤
(1)要除去NaCl溶液中的泥沙__________________
(2)用CCl4提取溴水中的溴单质_________________
(3)分离互溶的乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)__________________
(4)分离汽油和水_________________
(5)从含有少量的NaCl的KNO3溶液中提取KNO3_________________
(6)生石灰中含有石灰石的杂质_________________
现有①NaCl晶体 ②液态SO3 ③液态的醋酸 ④铝 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH) ⑧熔化的KNO3,请回答下列问题(填序号)
(1)属于电解质的是 。
(2)属于非电解质的是 。
(3)能导电的是 。
选修原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(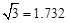 )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:(已知:NaCl熔点为801℃;AlCl3在181℃升华)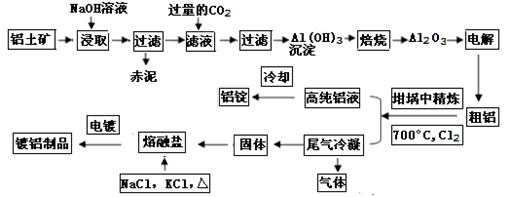
(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(4)向滤液中通入过量CO2所发生反应的离子方程式为 。
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_ 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:_____ClO3-+______Fe2++______=_____Cl-+_____Fe3++______
(3)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+K3
Fe(OH)3+H+K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3