氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)25℃时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①25℃时,该反应的平衡常数为 ;
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在120℃进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。
①b点时,溶液中发生水解反应的离子是 ;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
(6分)下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配 料 |
氯化钠、碘酸钾 |
| 含碘量 |
(20mg~40mg)/1kg |
| 保质期 |
18个月 |
| 食用方法 |
勿长时间炖炒 |
| 贮藏指南 |
避热、防潮 |
(1) 由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_______________。
(2) 已知碘在碘酸钾中的化合价为+5,碘酸钾的化学式为_________________。
(3)用单质碘(I2)与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为
_____________________________________________________________。
(5分)图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出: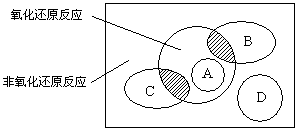
(1)若图中B圈表示化合反应,则C圈表示________反应(填基本反应类型,下同),A圈表示________反应,D圈表示________反应。
(2)B圈、C圈分别与氧化还原反应重叠的阴影部分用化学方程式各举出一例:
__________________________________;_________________________________。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
某兴趣小组采用如下方法制作氢氧燃料电池。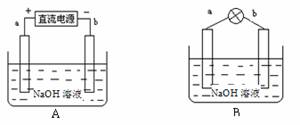
(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_________________,电解后溶液的pH____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为______________________________ _。
(3)假设a极吸收22.4L(标准状况)气体,能量转化率为60%,则通过二极管的电子的物质的量为______________。
氢氧燃料电池是最常见的燃料电池,该电池在正极通入氧气,在负极通入氢气,而电解质溶液通常是KOH溶液。
(1)请写出氢氧燃料电池的正极反应方程式。
(2)氢氧燃料电池有何优点?