(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<” )。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)10Be和9Be________。
a.是同一种原子
b.具有相同的中子数
c.具有相同的化学性质
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_______________。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是_________
_______________________________________________________________。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序________(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是________。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的________倍。
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示: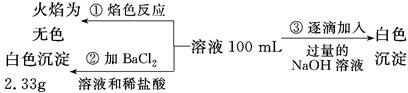

请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为____________________。
③试确定NO3—是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3—)=________(若不存在,此问不必作答)。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32—、SO42—,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
(1)一定不存在的离子是________(填离子符号,下同)。
(2)由①可知存在离子为________,浓度________。由②可知存在离子为________,浓度________。
由③可知存在离子为________,浓度________。
(3)K+是否存在?________(填“是”或“否”),理由是___________________________
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
| 阳离子 |
K+、Na+、Fe2+、Ba2+、NH4+ |
| 阴离子 |
OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为__________________。
②A、B溶液混合后加热呈中性,反应的离子方程式为__________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为_______________。
②经分析上述过程中溶液变黄的原因可能有两种:
Ⅰ._______ _____________________。Ⅱ.___________ ____________。
③请用一简易方法证明上述溶液变黄的原因__________________________________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_______________________________________