下列各组物质的分离或提纯,应选用下述方法的哪一种?(填字母即可)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、蒸发结晶 |
(1)除去 CaCl2溶液中悬浮的 CaCO3 ;
(2)从碘水中提取碘 ;
(3)用自来水制取蒸馏水 ;
(4)分离植物油和水 ;
(5)除去 NaCl 中所含的少量 KCl ;
(10分).已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。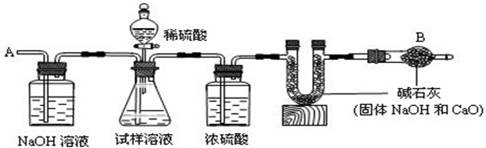
主要步骤如下,请填空:
①按图组装仪器,并检查装置的气密性②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③称量盛有碱石灰的U形管的质量为b g;④从分液漏斗中滴入6mol/L的稀硫酸,直到不再产生气体为止,⑤从导管A处缓缓鼓入一定量的空气;⑥再次称量盛有碱石灰的U形管的质量为c g;⑦重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为d g。
回答下列问题:(碱石灰是一种干燥剂,不能干燥酸性气体)
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成同浓度的盐酸,测试的结果将(填偏高.偏低或不变)
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)该试样中纯碱的质量分数的计算式为
学生为探究苯与溴发生反应的原理,用如图所示装置进行了实验。根据相关知识回答下列问题: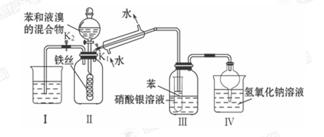
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在装置Ⅲ中可能观察到的现象除小试管中有气泡、液体变棕黄外还可能观察到的现象是_____ 。
(2)整套实验装置中能防止倒吸的装置有__________(填装置序号)。
(3)你认为通过该实验,有关苯跟溴反应的原理方面能得出的结论是__________ 。
(4)本实验能不能用溴水代替液溴? ______________ 。
(5)采用冷凝装置,其作用是_________________ 。
(6)Ⅲ装置中小试管内苯的作用是_____________ 。
(7)若实验时,无液溴,但实验室有溴水,该实验_____ (填“能”或“不能”)做成功
(5分)草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,做了如下实验:
①称取W g纯草酸晶体,将其配制成100.0 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为a mol•L-1的KMnO4标准溶液进行滴定,滴定时发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=====K2SO4+2MnSO4+l0CO2 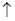 +8H2O
+8H2O
请回答:
(1)滴定时,将KMnO4标准液装在滴定管中,操作时用手拿锥形瓶。
(2)若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会(填“偏大”“偏小”或“不变’’)。
(3)假设滴定终点时,用去V mL KMnO4溶液,则待测草酸溶液的物质的量浓度为mol•L-1。
某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,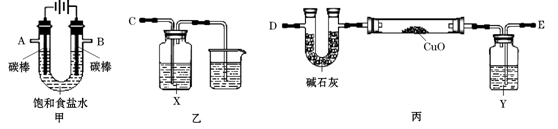
并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
(1)写出甲中反应的离子方程式。
(2)为完成上述实验,正确的连接顺序为A连,B连(填接口字母)。
(3)乙装置中X试剂可以是,丙装置中Y试剂的作用是。
(4)测定Cu的相对原子质量。将w g CuO置于硬质玻璃管中,足量的H2与之充分反应后,按以下两个方案测得的数据计算Cu的相对原子质量。
| 方案 质量 |
方案一 |
方案二 |
| U型管+固体 |
硬质玻璃管+固体 |
|
| 反应前质量/g |
a |
c |
| 完全反应后质量/g |
b |
d |
你认为方案较佳,另一个方案得到的Cu的相对原子质量会(填“偏低”、“偏高”)。按较佳方案计算,得到Cu的相对原子质量是。
下图是两个实验装置(铁架台等辅助仪器略去未画)②原混合物中碳酸钠的质量分数。