近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出了金刚石,具有深远的意义。下列说法中错误的是
A.由二氧化碳合成金刚石 是氧化还原反应 是氧化还原反应 |
| B.该反应中二氧化碳部分被还原为金刚石 |
| C.钠被氧化最终生成碳酸钠 |
| D.钠被氧化最终生成氧化钠 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是()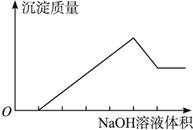
| A.Mg2+、Al3+、Fe2+ |
| B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ |
| D.只有Mg2+、Al3+ |
铝制品与铁制品相比,在空气中不易被锈蚀,原因是()
| A.铝的金属活动性比铁弱 |
| B.铝的密度比铁的密度小 |
| C.铝在空气中易形成一层致密的氧化膜 |
| D.铝不能跟氧气发生化学反应 |
从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是()
①地壳中的金属元素的含量②金属活动性③金属的导电性④金属冶炼的难易程度⑤金属的延展性
| A.①③ | B.②⑤ | C.③⑤ | D.②④ |
下列物质,不属于合金的是()
| A.硬铝 | B.黄铜 | C.钢铁 | D.水银 |
1989年世界卫生组织把铝确定为食品污染源之一,因此应控制使用。铝在下列应用时应加以控制的是()
①制铝合金②制电线③制炊具④银色漆颜料⑤明矾净水⑥明矾与苏打制食品膨松剂⑦易拉罐⑧用氢氧化铝凝胶制胃舒平药品⑨包装糖果和食品
| A.③⑤⑧⑨ | B.⑥⑧⑨ | C.③⑤⑨ | D.③⑤⑥⑦⑧⑨ |