由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为___ ____,其电极反应式为________ _______________。
____,其电极反应式为________ _______________。
②电解液d可以是_______,则白色沉 淀在电极上生成;也可以是_______,
淀在电极上生成;也可以是_______,
则白色沉淀在两极之间的 溶液中生成。
溶液中生成。
A.纯水 B.NaCl 溶液 C.NaOH溶液 D.CuCl2溶液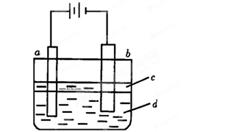
③液体c为苯,其作用是__________ ______,在加入苯之前,对d溶液进行加热处理的目的是____________________。
④为了在短时间内看到白色沉淀,可以采取的措施是____________________。
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到 白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________ ___________。
白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________ ___________。
写出下列为物质的电子式:
O(原子) H2S CaCl2 NaOH HClO
已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物。(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)请填写下列空白: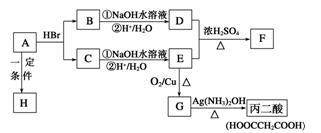
(1)A中含有的官能团有(写结构简式)。
(2)请写出下列有机物的结构简式:C;F。
(3)请指出下列反应的反应类型:A—→B; C—→E。
(4)G中不同化学环境的氢原子有种。
(5)请写出下列反应的化学方程式:
①A—→H;②B—→D(第①步)__。
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式,基态Z原子的核外电子排布式为。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有(写两条)。
(3)ET2的空间构型为,为分子(填“极性”或“非极性”)
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是()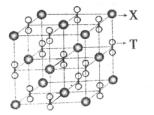
| A.每个晶胞中含有14个心和13个O2- |
| B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+ |
| C.晶体中与每个K距离最近的K+有8个 |
| D.晶体中,O价氧原子与-2价氧原子的数目比为3:l |
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的 杂化方式均为。
杂化方式均为。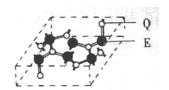
相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质的物质的量(mol) |
达平衡时体系的变化 |
||
| I2 |
H2 |
HI |
||
| ① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
| ② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
| ③ |
0 |
4 |
4 |
|
| ④ |
2 |
3 |
0 |
(1)下列叙述正确的是
| A.四个容器中反应的平衡常数相等 | |
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g)△ H =23.15kJ/mol 2HI(g)△ H =23.15kJ/mol |
|
| C.平衡时,容器④中H2的转化率高于① | D.容器②中达平衡时放出的热量Q2<23.15kJ |
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min, 则平均反应速率v(HI)=,该温度下,反应H2(g)+I2(g)
则平均反应速率v(HI)=,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K=。
2HI(g)的平衡常数 K=。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于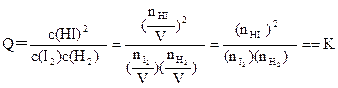 ,
,
可判断平衡将(填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将(填“正向”、“逆向”或“不”)移动,理由是。
已知X是一种盐,H是一种古代劳动人民就已掌握冶炼技术的金属单质,F、P、J是常见的非金属单质,I、E、G都是工业上重要的碱性物质,P和J在一定条件下反应生成I。它们有右图所示的关系,试回答下列问题: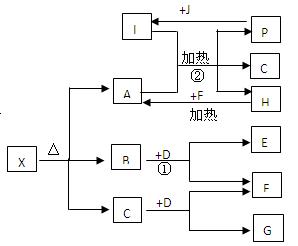
(1)G的化学式为;
(2)写出下列反应的化学方程式:
①;
②;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是
____________________________________________;
丙装置中药品的名称为________________,实验时,该药品未见明显变化,证明____________________________________________;
③ 如何判断X已完全分解?
__________________________________________________
___________________________________________________________________________________________________。
④ 更精确的测定得出如下数据:X受热后完全分解,固体由16.52 g变为12.00 g,装置乙增重1.44 g。写出X的化学式________________________。
请写出X与盐酸反应的化学方程式为:
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素
CO(NH2)2 和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式。