实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应:

1.NO的制备
(1)在加药品之前首先应进行的操作是 (填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部。
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验)。
(4)将注射器插入稀 中,吸取适量的
中,吸取适量的 稀
稀 ,然后迅速关闭阀门K,请回答此时可能观察到的实验现象: 。
,然后迅速关闭阀门K,请回答此时可能观察到的实验现象: 。
反应的离子方程式为:  ,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
Ⅱ.NO性质实验
(1)观察注射器内气体呈 色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈 色,反应的化学方程式为: 。
(2)向下快速推动活塞J,注射器内气体颜色变化情况为: ,原因是 (结合化 学方程式并配以必要的文字说明)。
学方程式并配以必要的文字说明)。
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
①;
②;
③;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称:。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是
I ;II ;III ;
IV(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是。
(3)使用装置II的目的是。
(4)使用装置III的目的是。
(5)确定含有乙烯的现象是。
(满分12分)用中和滴定法测定某烧碱样品的纯度。
⑴配制待测液: 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有___________________________________________。
⑵滴定: ①盛装0.20mol/L盐酸标准液应该用_______滴定管。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视________,滴定终点时,锥形瓶中的溶液的颜色变化是__________。
③有关数据记录如下:
| 滴定序号 |
待测液体积 (mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.70 |
| 2 |
20.00 |
6.00 |
26.00 |
⑶纯度计算:NaOH溶液的浓度为____________mol/L,烧碱样品的纯度为_________。
⑷对几种假定情况的讨论(填无影响、偏高、偏低)
①若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
②读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
实验室可以通过加热酒精和浓硫酸制备乙烯。但是产生的乙烯中有二氧化硫.而乙烯和二氧化硫都能使酸性高锰酸钾和溴水褪色。
完成下列化学方程式
A.二氧化硫使溴水褪色:
B.乙烯使溴水褪色:
(2)有人设计以下方案证明实验中产生的气体中既有二氧化硫又有乙烯如图所示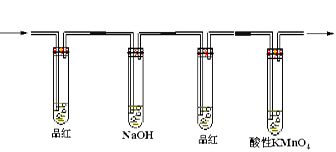
A B C D
回答以下问题
①能够说明有二氧化硫气体的现象
②使用装置的目
③使用装置的目的
④证明含有乙烯的现象
(共12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。实验室可以用装置F制备氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
请回答下列问题:
(1)、装置F中发生反应的离子方程式为_______________________________________;
(2)、为了快速制备氨气,装置A的烧瓶中可装试剂_____________________;
(3)、B装置的名称是_____________;(填符号) A.洗气瓶 B.干燥管 C.分液漏斗
E装置的作用是__________________________________________________________;
(4)通入C装置的两根导管左边较长、右边较短,目的是________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:_________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。