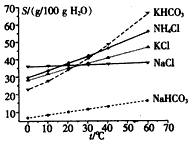
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)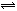 CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0; B.△H>0,△S<0;
C .△H<0,△S<0; D.△H<0,△S>0。
.△H<0,△S<0; D.△H<0,△S>0。
(2)该图中能量的最高点和最低点之间的差值代表
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2
和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。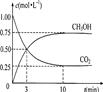
(4)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。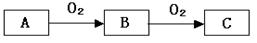
(1)若A是一种黄色单质固体,则B→C的化学方程式为。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为,试用化学方程式表示该物质与二氧化碳气体的反应。将C长期露置于空气中,最后将变成物质D,D的化学式为。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为。
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题: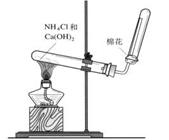
①收集A的方法是,验证A是否已经收集满的方法是(任写一种)。
②写出实验室制取A的化学方程式。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
④试写出C与水反应的化学方程式,反应可得到酸X,X是电
解质(填“强”或“弱”)。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)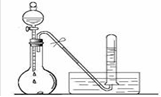
现有下列十种物质:
①H2;②铝;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为。
(3)⑩在水中的电离方程式为,
(4)少量的④通入⑥的溶液中反应的离子方程式为。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是(填化学式),氧化剂与还原剂的物质的量之比是,当有5.4g Al发生反应时,转移电子的物质的量为。该反应的离子方程式为。
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是B的化学式是。
②原白色粉末中一定含有,可能含有,
对可能含有的物质,可通过(填实验名称)进一步检验。检验操作步骤有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。其中正确的操作顺序为。
A.①②③④ B.④①②③ C.④②①②③④ D.①③②④
[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性。
(1)E基态原子的核外电子轨道式为____________________________________________。第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为_______________。
(2)CD3-的空间构型为_______________________。
(3)A、B、D三元素组成的一种化合物X是家庭装修材料中常含有的一种有害气体,X分子中的中心原子采用_____________杂化。
(4)F(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,B、D 分子内σ键与π键的个数之比为______________。
(5)一种EF的合金晶体具有面心立方最密堆积的结构。在晶胞中,F位于顶点,E位于面心,该合金中EF的原子个数之比为_________________。若晶胞边长a pm,则合金密度为______________g·cm3(列式表达,不计算)。
[化学——选修2:化学与技术](15)
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。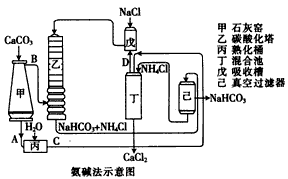
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。